摘要:A 2.B 3.A 4.B 5.D 6.D 7.C 8.A 9.B 10.C
网址:http://m.1010jiajiao.com/timu3_id_383396[举报]
A、B、C、D是四种短周期元素,E是过渡元素.A、B、C同周期,C、D同主族,A的原子结构示意图为: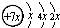 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
(1)写出下列元素的符号:A
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(4)D的氢化物比C的氢化物的沸点
(5)E元素原子的核电荷数是
(6)A、B、C最高价氧化物的晶体类型是分别是
(7)画出D的核外电子排布图
 ,这样排布遵循了
,这样排布遵循了
查看习题详情和答案>>
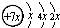 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:(1)写出下列元素的符号:A
Si
Si
BNa
Na
CP
P
DN
N
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
HNO3
HNO3
,碱性最强的是NaOH
NaOH
.(3)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
F
F
,电负性最大的元素是F
F
.(4)D的氢化物比C的氢化物的沸点
高
高
(填“高“或“低“),原因氨气分子之间含有氢键
氨气分子之间含有氢键
(5)E元素原子的核电荷数是
26
26
,E元素在周期表的第四
四
周期,第Ⅷ
Ⅷ
族,已知元素周期表可按电子排布分为s区、p区等,则E元素在d
d
区.(6)A、B、C最高价氧化物的晶体类型是分别是
原子
原子
晶体、离子
离子
晶体、分子
分子
晶体(7)画出D的核外电子排布图


泡利
泡利
原理和洪特
洪特
规则.5-氨基酮戊酸盐是一种抗肿瘤药,其合成路线如下:

已知:R-NO2
R-NH2
(1)5-氨基酮戊酸盐中非含氧官能团的名称是
(2)C→D的反应类型为
(3)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一种环境的氢原子,则A的结构简式为
 .
.
(4)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式 (任写一个)
(任写一个) (任写一个).
(任写一个).
(5)写出D→E反应的化学方程式
 .
.
(6)已知 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、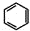 为原料合成
为原料合成 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
①第一步的合成路线:

②最后一步的化学方程式: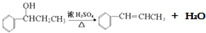
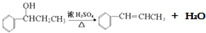 .
.
查看习题详情和答案>>

已知:R-NO2
| H2 | Pd/C |
(1)5-氨基酮戊酸盐中非含氧官能团的名称是
氨基
氨基
.(2)C→D的反应类型为
取代反应
取代反应
.(3)已知A分子结构中有一个环,A不能使溴水褪色,且核磁共振氢谱图上只有一种环境的氢原子,则A的结构简式为


(4)G是B的一种同分异构体,能与NaHCO3溶液反应,能发生银镜反应,1molG与足量金属Na反应能生成1molH2,且G分子中不含甲基,写出一种符合上述条件的G的结构简式
 (任写一个)
(任写一个) (任写一个)
(任写一个)(5)写出D→E反应的化学方程式


(6)已知
 ,请结合题中所给信息,写出由CH3CH2COOH、
,请结合题中所给信息,写出由CH3CH2COOH、 为原料合成
为原料合成 单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).
单体的第一步的合成路线和最后一步的化学方程式(无机试剂任选).①第一步的合成路线:


②最后一步的化学方程式:
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A-I的所有物质之间有如下的转化关系: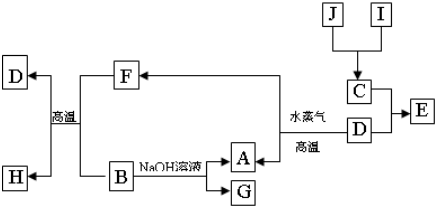
回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
(2)写出B与F反应的化学方程式
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?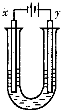
另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
(5)G的水溶液显
(6)J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
查看习题详情和答案>>

回答下列问题:
(1)写出物质C的构成元素在周期表中的位置
第三周期、第ⅦA族
第三周期、第ⅦA族
.(2)写出B与F反应的化学方程式
8Al+3Fe3O4
9Fe+4Al2O3
| ||
8Al+3Fe3O4
9Fe+4Al2O3
.
| ||
(3)由E的饱和溶液可以制得胶体,具体制备方法是:
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
将饱和FeCl3溶液逐滴加入沸水中,继续加热至液体变为红褐色
,用化学方程式表示该过程的原理:Fe3++3H2O
Fe(OH)3(胶体)+3H+
| ||
Fe3++3H2O
Fe(OH)3(胶体)+3H+
.若要提纯该胶体,采用的操作方法叫
| ||
渗析
渗析
.此液体具有的性质是abd
abd
(填写序号字母)a.光束通过该液体时形成光亮的“通路”?
b.向液体中逐滴加入足量氢碘酸,先有沉淀产生,后沉淀逐渐溶解,再滴入几滴淀粉溶液,溶液变为蓝色
c.向该液体中加入硝酸银溶液,无沉淀产生?
d.将该液体加热、蒸干、灼烧,得红棕色固体?

另取少量上述胶体置于U型管中,按如图装置图连接好装置.通电一小段时间后,X极附近的现象是
红褐色加深
红褐色加深
.(4)取少量上述胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液颜色逐渐变浅,最终得到黄色的溶液,发生此变化的离子方程式为
Fe(OH)3+3H+=Fe3++3H2O
Fe(OH)3+3H+=Fe3++3H2O
.(5)G的水溶液显
碱
碱
性(填酸或碱);原因是(用离子方程式表 示)AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
 Al(OH)3+OH-
Al(OH)3+OH-AlO2-+2H2O Al(OH)3+OH-
Al(OH)3+OH-
. Al(OH)3+OH-
Al(OH)3+OH-(6)J在H2O2分解反应中作催化剂.若将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
MnO2+H2O2+2H+═Mn2++O2↑+2H2O
.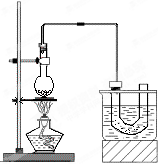 、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)
、实验室制备溴乙烷(C2H5Br)的装置和步骤如图:(已知溴乙烷的沸点38.4℃)①检查装置的气密性,向装置图所示的U形管和大烧杯中加入冰水;
②在圆底烧瓶中加入10mL95%乙醇、28mL80%浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;
③小心加热,使其充分反应.
回答下列问题:
(1)该实验制取溴乙烷的化学方程式为:
NaBr+H2SO4+C2H5OH
NaHSO4+C2H5Br+H2O
| △ |
NaBr+H2SO4+C2H5OH
NaHSO4+C2H5Br+H2O
| △ |
(2)反应时若温度过高,可看到有红棕色气体产生,该气体分子式为
Br2
Br2
,同时还生成另一种无色气体.(3)U型管内可观察到的现象是
有油状液体生成
有油状液体生成
.(4)反应结束后,U形管中粗制的C2H5Br呈棕黄色.为了除去粗产品中的杂质,可选择下列试剂中的
C
C
(填字母)A.NaOH溶液 B.H2O C.Na2SO3溶液 D.CCl4
所需的主要玻璃仪器是
分液漏斗
分液漏斗
(填仪器名称).要进一步制得纯净的C2H5Br,可用水洗,然后加入无水CaCl2,再进行蒸馏
蒸馏
(填操作名称).(5)下列几项实验步骤,可用于检验溴乙烷中溴元素,其正确的操作顺序是:取少量溴乙烷,然后
④①⑤③②
④①⑤③②
(填代号).①加热;②加入AgNO3溶液;③加入稀HNO3酸化;④加入NaOH溶液;⑤冷却
(6)溴乙烷(C2H5Br)多一个碳的同系物所有可能的物质在氢氧化钠的醇溶液中能发生反应,写出该反应的化学方程式
CH3CH2CH2Br+NaOH
CH3CH=CH2+NaBr+H2O
| 醇 |
| △ |
CH3CH2CH2Br+NaOH
CH3CH=CH2+NaBr+H2O
,| 醇 |
| △ |
CH3CHBrCH3+NaOH
CH3CH=CH2+NaBr+H2O
| 醇 |
| △ |
CH3CHBrCH3+NaOH
CH3CH=CH2+NaBr+H2O
.| 醇 |
| △ |
A、B、C、D为按顺序排列的前四种卤素单质,仔细分析下表中的数据,回答有关问题.
(1)在标准状况下为液体的卤素单质是
(2)A的相对分子质量为
(3)写出B与水反应的化学方程式
(4)卤素单质B、C、D的氧化性由大到小的顺序为
查看习题详情和答案>>
| 卤素单质 | 密度(标准状况下) | 沸点/℃ | 熔点/℃ | 溶解度(标准状况下,100g水中) |
| A | 1.696 g?l-1 | -188.1 | -219.6 | -- |
| B | 3.214 g?l-1 | -34.6 | -101 | 226 cm3 |
| C | 3.119 g?cm-3 | 58.78 | -7.2 | 4.16 g |
| D | 4.93 g?cm-3 | 184.4 | 113.5 | 0.029 g |
C
C
(填字母,下同),为固体的卤素单质是D
D
.(2)A的相对分子质量为
38
38
(保留整数)(3)写出B与水反应的化学方程式
Cl2+H2O═HCl+HClO
Cl2+H2O═HCl+HClO
(4)卤素单质B、C、D的氧化性由大到小的顺序为
Cl2>Br2>I2
Cl2>Br2>I2
(用化学式表示)