网址:http://m.1010jiajiao.com/timu3_id_383335[举报]
| 名称 | 结构简式 | 常温时的状态 | 熔点/℃ | 沸点/℃ | 相对密度 |
| 甲烷 | CH4 | 气 | -182.5 | -161.5 | |
| 乙烷 | CH3CH3 | 气 | -182.8 | -88.6 | |
| 丙烷 | CH3CH2CH3 | 气 | -188.0 | -42.1 | 0.5005 |
| 戊烷 | CH3(CH2)3CH3 | 液 | -129.7 | 36.0 | 0.5572 |
| 癸烷 | CH3(CH2)8CH3 | 液 | -29.7 | 174.1 | 0.7298 |
| 十七烷 | CH3(CH2)15CH3 | 固 | 22 | 302.2 | 0.7767 |
(2)烷烃的同分异构体的数目随碳原子数的增加而增加,丁烷有两种同分异构体,其结构简式分别是
(3)乙烯产量是衡量一个国家石油化工发展水平的标志,它的分子结构模型如图所示.

①请写出乙烯的电子式
②工业上可用乙烯与水反应来生产工业酒精,该反应的化学方程式为(不要求写反应条件);
③由乙烯制聚乙烯的化学方程式是
(4)甲烷和乙烯都是无色气体,请写出一种能够鉴别两者的试剂
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g?L-1 |
| 排放标准 | pH 6~9 | 0.5mg?L-1 |
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol?L-1,c(AsO43-)=
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3K2=1.7×10-7K3=4.0×10-12,
第三步电离的平衡常数的表达式为K3=
(6分)菠萝酯是一种具有菠萝香气的食用香料,是化合物甲与苯氧乙酸()发生化
|
(1)甲一定含有的官能团的名称是 。
(2)5.8 g甲完全燃烧可产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中
不含甲基,且为链状结构,其结构简式是
(3)苯氧乙酸有多种同分异构体,写出任意一种含苯环结构的同分异构体的结构简式
查看习题详情和答案>>
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
|
名称 |
托盘天平 (带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
|
|
|
|
|
|
|
序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
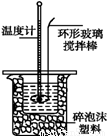
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
|
温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差 平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.6 |
|
|
2 |
27.0 |
27.4 |
27.2 |
31.2 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看习题详情和答案>>
(6分)依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g乙醇燃烧生成CO2和液态水时放热29.7kJ。则表示乙醇燃烧热的热化学方程式为_____________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热
量_________________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________





