摘要:为了除去SO2气体中含有的少量HCl.最好将气体通过( ) A.浓H2SO4 B.Na2SO3饱和溶液 C.NaHSO3饱和溶液 D.固体NaOH
网址:http://m.1010jiajiao.com/timu3_id_383279[举报]
(1)某化工厂排出的废水中含有Cl2和H2SO4,为了除去此废水中的游离氯,并使废水变为中性,供使用的试剂有Na2CO3溶液和Na2SO3溶液。试完成下列问题:
①应先向废水中加入________溶液,离子方程式为________________________。
②然后向废水中加入________溶液,离子方程式为________________________。
(2)有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。将气体通入适量氯水中,得到无色透明溶液,继续向该溶液中加入少量的BaCl2溶液和盐酸,则产生白色沉淀。原气体中肯定含有______,肯定不含有______,可能含有______。
查看习题详情和答案>>海水是宝贵的自然资源,从海水中可以提取多种化工原料,某工厂对海水综合利用的示意图如下所示:
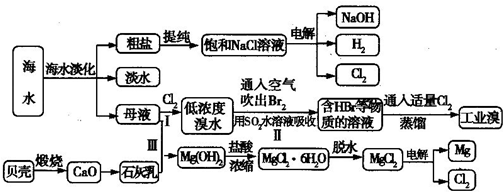
(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
(2)工业上电解饱和食盐水的离子方程式为
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A.H2 B.CO2 C.空气 D.O E.水蒸气.
查看习题详情和答案>>

(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
②④③①或③②④①或②③④①
②④③①或③②④①或②③④①
(填编号).(2)工业上电解饱和食盐水的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
富集溴元素;
富集溴元素;
.步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=4H++SO42-+2Br-
.(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
氯化镁
氯化镁
溶液,充分搅拌后经过滤
过滤
(填操作方法)可得纯净的Mg(OH)2.(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
.(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A
A
(填序号).A.H2 B.CO2 C.空气 D.O E.水蒸气.
下列表述不正确的是( )
| A.131I与127I互为同位素,化学性质几乎相同 |
| B.pm 2. 5含有铅、镉、铬、钒等对人体有害的金属元素 |
| C.除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 |
| D.为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
下列表述不正确的是( )
| A、福岛核电站泄露的放射性物质131I与127I互为同位素,化学性质几乎相同 | B、pm 2.5含有铅、镉、铬、钒等对人体有害的金属元素 | C、除去SO2中混有的少量HCl,使气体通过盛有饱和NaHSO3溶液的洗气瓶 | D、为了证明氢氧化钠是离子化合物,可在瓷坩埚中将氢氧化钠固体熔化后测其导电性 |
(2013?湛江二模)为了探究SO2与Na2O2的反应是否类似于CO2,甲同学设计了如图实验装置.回答下列问题:

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式
(2)乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是
按照乙同学的观点,该装置需作的改进是:
(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:
①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2mol?L-1 HCl,1mol?L-1HNO3,1mol?L-1 BaCl2,1mol?L-1 Ba(NO3)2,
(0.01mol?L-1KMnO4酸性溶液.)
(4)生成物中亚硫酸钠含量的测定:①取a克生成物配制成100ml溶液,取10.00mL该溶液于锥形瓶中,加入几滴淀粉溶液作指示剂,用0.0100mol?L-1碘水进行滴定,滴定终点现象为
②计算:生成物中亚硫酸钠的质量分数为
查看习题详情和答案>>

(1)移开棉花,将带火星的木条放在C试管口,未见木条复燃.甲同学因此认为SO2与Na2O2的反应不同于CO2.请按甲同学的观点写出反应的化学方程式
SO2+Na2O2=Na2SO4
SO2+Na2O2=Na2SO4
.(2)乙同学认为无论反应原理如何,最终都有O2产生.乙同学的理由是
A中生成的SO2气体中含有水蒸气
A中生成的SO2气体中含有水蒸气
.按照乙同学的观点,该装置需作的改进是:
在A和B之间连接一个装有浓硫酸的洗气瓶
在A和B之间连接一个装有浓硫酸的洗气瓶
.(3)假设Na2O2完全反应,反应后B装置中固体生成物可能是:
①Na2SO3; ②Na2SO4; ③Na2SO3和Na2SO4
请设计实验方案检验,写出实验步骤以及预期现象和结论,完成下表:
限选试剂:2mol?L-1 HCl,1mol?L-1HNO3,1mol?L-1 BaCl2,1mol?L-1 Ba(NO3)2,
(0.01mol?L-1KMnO4酸性溶液.)
| 实验步骤 | 预期现象和结论 |
| 步骤1:取B中的少量固体样品于试管中,滴加足量蒸馏水,溶解,然后取少量待测液分别置于Ⅰ、Ⅱ试管中. | 固体完全溶解 |
| 步骤2:往Ⅰ试管中加入 足量的1 mol?L-1盐酸 足量的1 mol?L-1盐酸 ,再滴加1 mol?L-1 BaCl2溶液 1 mol?L-1 BaCl2溶液 . |
有白色沉淀生成 有白色沉淀生成 ,则证明生成物中含Na2SO4. |
| 步骤3:往Ⅱ试管中 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 2~3滴0.01mol?L-1KMnO4酸性溶液,振荡 删除此空 删除此空 . |
若 KMnO4溶液紫红色褪去 KMnO4溶液紫红色褪去 ,则说明生成物中有Na2SO3;若 KMnO4溶液紫红色不褪去 KMnO4溶液紫红色不褪去 删除此空 删除此空 ,则说明生成物中没有Na2SO3. |
溶液出现蓝色,且半分钟内不褪去
溶液出现蓝色,且半分钟内不褪去
,记录数据,重复滴定2次,平均消耗碘水20.00mL.②计算:生成物中亚硫酸钠的质量分数为
0.252/a
0.252/a
.