摘要:工业上冶炼晶体硅所用的粗硅中所含有的主要成分是Si和SiC.生产粗硅过程中所涉及的反应有: (1)若生产过程中参加反应的SiO2和C的质量之比为2:1.则得到的粗硅中.Si和SiC的物质的量之比 . A.1:1 B.1:2 C.1:3 (2)某粗硅样品中.经测定硅与碳的物质的量之比为3: 1.则样品中单质硅的质量分数 . (3)若SiO2和C的混合物1mol.在高温中充分反应.根据反应方程式.从理论上思考.讨论反应后固体中Si的物质的量(y)和原混合物中C的物质的量(x)之间的关系. ①当x是 mol时.产品中Si的含量最高. A.1/2 B.1/3 C.2/3 D.3/4 ②讨论反应后固体中Si的物质的量(y)和原混合物中C的物质的量(x)之间的关系.填完整下表. x的取值范围 y和x的关系式 y=0.5x 0.75mol<x<1 mol
网址:http://m.1010jiajiao.com/timu3_id_383215[举报]
按要求完成以下方程式:
(1)工业上用电解法制备Na单质的化学方程式: .
(2)向NaAlO2溶液中通入过量CO2的离子方程式: .
(3)工业上生产晶体硅的化学方程式: .
(4)MnO2与浓盐酸制备氯气的化学方程式: .
查看习题详情和答案>>
(1)工业上用电解法制备Na单质的化学方程式:
(2)向NaAlO2溶液中通入过量CO2的离子方程式:
(3)工业上生产晶体硅的化学方程式:
(4)MnO2与浓盐酸制备氯气的化学方程式:
下列叙述正确的是
A.酸雨的形成主要是由于森林的滥砍滥伐
B.用在航天器上的抗氧化陶瓷复合材料属于新型有机高分子材料
C.利用海水不经化学变化即可制得食盐和淡水
D.工业上用晶体硅制造光导纤维
查看习题详情和答案>>按要求完成以下方程式:
(1)工业上用电解法制备Na单质的化学方程式:_________________________________。
(2)向NaAlO2溶液中通入过量CO2的离子方程式:_______________________________。
(3)工业上生产晶体硅的化学方程式:___________________________________________。
(4)MnO2与浓盐酸制备氯气的化学方程式:______________________________________。
查看习题详情和答案>>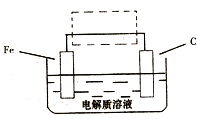 (2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(2010?临沂一模)Fe元素是地壳中最丰富的元素之一,在金属中仅次于铝,铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe304+4CO
| ||
8
8
mol;(2)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
因酸性废液中,将会Fe3+抑制的水解,无法得到Fe(OH)3胶体,故不能够吸附悬
;(3)钢铁的电化腐蚀简单示意图如右,将该图稍作修改即可成为钢铁电化学防护的简单示意图,请在下图虚线框内作出修改,并用箭头标出电子流动方向


(4)硫酸亚铁晶体(FeS04?7H20)常作医药上的补血剂.课外研究性小组测定该补血剂中铁元素的含量.实验步骤如下:
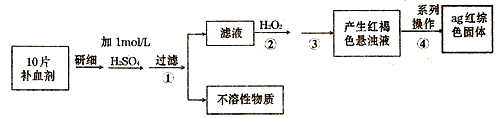
请回答下列问题:
①证明步骤①所得滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加H2O2,此过程的现象为:
H2O2溶液由浅绿色变为血红色
H2O2溶液由浅绿色变为血红色
;②若该实验温度下,步骤③中难溶物的溶度积为Ksp=8×l0-38,试计算该物质沉淀完全所需要的pH=
3.3
3.3
(已知溶液中离子浓度小于10-5mol时,该离子可看做沉淀完全;lg2=0.3);③步骤④中一系列的操作步骤为:过滤、
洗涤
洗涤
、灼烧、冷却、称量;④若实验过程中无损耗,最后称量得到a克红棕色的固体,则每片补血剂中含铁元素的质量为
0.07a
0.07a
g.(用含a的式子表示)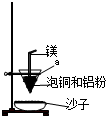 工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.
工业上冶炼冰铜(mCu2O?nFeS)可得到粗铜,再以粗铜为原料制备硫酸铜晶体.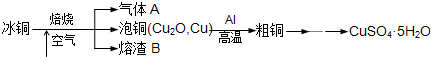
完成下列填空:
(1)气体A中的大气污染物可选用下列试剂中的
cd
cd
(填序号)吸收.a.浓H2SO4 b.浓HNO3
c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加
硫氰化钾
硫氰化钾
(填物质名称)溶液后呈红色,说明溶液中存在Fe3+,检验溶液中还存在Fe2+的方法是另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+
另取少量溶液,滴加几滴高锰酸钾的酸性溶液,紫色褪去,说明溶液中存在Fe2+
(注明试剂、现象).实验室可用如图的装置完成泡铜冶炼粗铜的反应.(3)泡铜冶炼粗铜的化学方程式是
3Cu2O+2Al
6Cu+Al2O3
| ||
3Cu2O+2Al
6Cu+Al2O3
.
| ||
(4)装置中镁带的作用是
燃烧放出大量的热,创造高温环境(或引燃剂)
燃烧放出大量的热,创造高温环境(或引燃剂)
.泡铜和铝粉混合物表面覆盖少量白色固体a,a是氯酸钾
氯酸钾
(填名称).沙子能否换成水?不能
不能
(填“能”或“不能”).(5)用滴定法测定CuSO4?5H2O的含量.取a g试样配成100mL溶液,取20.00mL用c mol/L (H2Y2-,滴定剂不与杂质反应)滴定至终点,消耗滴定剂bmL滴定反应:Cu2++H2Y2-?
| 滴定剂 |
| 5bc |
| 4a |
| 5bc |
| 4a |
(6)下列操作会导致CuSO4?5H2O含量的测定结果偏高的是
c
c
.a.滴定临近终点时,用洗瓶中的蒸馏水洗下滴定管尖嘴口的半滴标准液至锥形瓶中
b.滴定管用蒸馏水洗涤后,直接注入待测液,取20.00mL进行滴定
c.滴定前,滴定管尖端有气泡,滴定后气泡消失.