网址:http://m.1010jiajiao.com/timu3_id_382106[举报]
(8分)某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液:
(F)从分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。
就此实验,完成下列填空。
(1) 正确操作步骤的顺序是:(用上述各操作的编号字母填写)(2分)
_____® _____® _____® A ® G ® _____ ® E ® F
(2) 上述(E)步骤接收溶液时应注意(3分)
(3) 能选用CCl4从碘水中萃取碘的原因是(3分)
查看习题详情和答案>>
(8分)某化学课外小组用海带为原料制取了少量碘水。现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液。其实验操作可分解为如下几步:
(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50 mL碘水和15 mL CCl4加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液:
(F)从分液漏斗上口倒出上层水溶液;
(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;
(H)静置,分层。
就此实验,完成下列填空。
(1) 正确操作步骤的顺序是:(用上述各操作的编号字母填写)(2分)
_____® _____® _____® A ® G ® _____ ® E ® F
(2) 上述(E)步骤接收溶液时应注意(3分)
(3) 能选用CCl4从碘水中萃取碘的原因是(3分)
查看习题详情和答案>>
(8分).某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。试验流程如下:
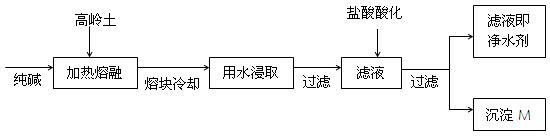
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似。用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式 、
。
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器 (填写编号)
| A.铁坩埚 | B.瓷坩埚 | C.氧化铝坩埚 | D.玻璃坩埚 |
(8分)某校化学兴趣小组,通过下列装置探究Na2CO3和NaHCO3的热稳定性,设计如下的探究方案,请你参与并完成该探究方案。
(1)提出假设:Na2CO3或NaHCO3加热分解时可能有CO2生成。
(2)设计实验:①利用右图装置分别对一定量的Na2CO3和NaHCO3进行加热;②为了检验CO2的生成,试管B中应加入的物质是 (填“澄清的石灰水”或“NaOH溶液”)
(3)现象与结论:同学们发现只有在加热NaHCO3时,试管B中才有气泡产生且有 沉淀生成(填沉淀的颜色),说明Na2CO3和NaHCO3的热稳定性是:Na2CO3 NaHCO3(填“>”或“<”)。
(4)某同学在探究NaHCO3的热稳定性时,称取了8、4gNaHCO3,充分加热,请你计算理论上可产生CO2气体的体积为 L(标准状况)
查看习题详情和答案>>
(8分)某同学用铅蓄电池作电源,用石墨做电极电解500 mL某浓度的CuSO4溶液,观察到A电极表面有红色固体物质生成,当溶液中原有溶质完全电解后,停止通电,取出A电极,洗涤、干燥、称量,电极增重1.6 g。已知铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
2PbSO4+2H2O
请按要求回答下列问题:
(1)电解CuSO4溶液的化学方程式 ,
(2)当反应过程中转移的电子为0.02mol时,铅蓄电池内消耗硫酸的物质的量为 mol。
(3)电解前CuSO4溶液的物质的量浓度为 。
(4)若电解前后溶液的体积不变,电解后溶液的pH=
(5)写出铅蓄电池负极的电极反应式:
查看习题详情和答案>>