网址:http://m.1010jiajiao.com/timu3_id_381973[举报]
平衡常数KC的数值大小,是衡量化学反应进行程度的标志。在25℃时,下列反应的平衡常数如下:
N2(g) + O2(g) ![]() 2NO(g) K1 = 1×10-30
2NO(g) K1 = 1×10-30
2H2(g) + O2(g) ![]() 2H2O(g) K2 = 2×10 81
2H2O(g) K2 = 2×10 81
2CO2 (g) ![]() 2CO(g)+O2(g) K3 = 4×10-92
2CO(g)+O2(g) K3 = 4×10-92
(1)常温下,NO分解产生O2反应的平衡常数的表达式为K = 。
(2)常温下,水分解产生O2,此时平衡常数值约为K = 。
(3)常温下,NO,H2O,CO2 三种化合物分解放出氧气的倾向大小顺序为 。
(4)北京市政府要求全市对所有尾气处理装置完成改装,以求基本上除去氮氧化物、一氧化碳污染气体的排放,而改装后的尾气处理装置主要是加入有效催化剂,你根据以上有关数据分析,仅使用催化剂除污染气体的可能性。
查看习题详情和答案>>已知在一定条件下,SO2和O2发生如下反应:2SO2(g)+O2(g)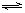 2SO3(g) ΔH<0,当反应达到平衡后,存在化学平衡常数:Kc=
2SO3(g) ΔH<0,当反应达到平衡后,存在化学平衡常数:Kc=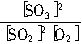 。
。
(1)降低温度,该反应达到平衡后的Kc值_____(填“增大”、“减小”或“不变”,下同),二氧化硫的转化率_____,化学反应速率_______。
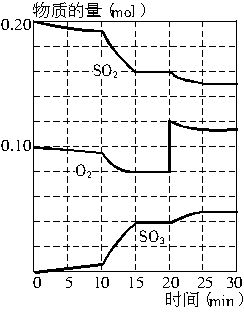
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3的物质的量变化如上图所示,反应处于平衡状态的时间是_______。
(3)据图判断,反应进行至10min时曲线变化的原因可能是________(填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
查看习题详情和答案>>
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)―2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示。
 (1)该反应进行到__________时达到平衡,用AB表示的平均反应速率为:__________(分数表示)。
(1)该反应进行到__________时达到平衡,用AB表示的平均反应速率为:__________(分数表示)。
(2)图中对应的a的数值是_________,该反应的化学平衡常数Kc=__________(保留分数)。温度升高Kc值___________(填“增大”、“减少”或“不变”)。
(3)在上述反应达到平衡后,第4min时,若将容器的体积快速扩大一倍(其他条件不变),请在上图中画出4min~5min的AB浓度的变化线。
(4)在相同条件下,若开始时向此容器中加入的A2(g)、B2(g)和AB(g)的物质的量分别为0.4mol、0.2mol、0.8mol。则反应向__________方向进行(填“正反应”或“逆反应”)。判断依据是______________;反应达到平衡后,各物质的体积分数与原平衡相比___________(填序号)
①A2、B2减小,AB增大 ②A2、B2增大,AB减小 ③均不变 ④无法确定
查看习题详情和答案>>(16分)汽车尾气是城市空气的主要污染物之一,其主要有害成分是CO、氮氧化物(NOx)等。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,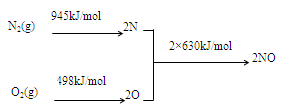
则:N2(g)+O2(g)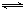 2NO(g) △H= 。
2NO(g) △H= 。
(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。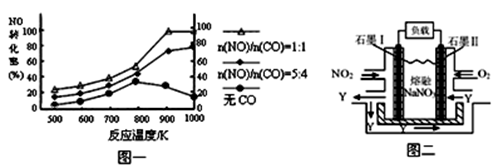
① NO与CO混存时,相互反应的化学方程式为 。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为 。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在 K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的 极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为 。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)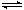 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。
① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为 。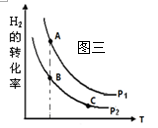
② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为 。
(1)NOx产生的原因之一是汽车发动机工作时引发N2和O2反应,其能量变化值如右图所示,

则:N2(g)+O2(g)
 2NO(g) △H= 。
2NO(g) △H= 。(2)汽车尾气中CO、NOx的有效消除成为环保领域的重要课题。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图一。

① NO与CO混存时,相互反应的化学方程式为 。
② 1000K,n(NO)/n(CO)=5:4时,NO的转化率为75%,则CO的转化率约为 。
③ 由于n(NO)/n(CO)在实际过程中是不断变化的,保证NO转化率较高的措施是将温度大约控制在 K之间。
(3)汽车尾气中NOx有望通过燃料电池实现转化。已经有人以 NO2、O2和熔融NaNO3制成了燃料电池,其原理如图二。
① 图中石墨Ⅱ为电池的 极。
② 在该电池使用过程中,石墨I电极上的产物是氧化物Y,其电极反应式为 。
(4)甲醇也可用于燃料电池。工业上采用反应CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0合成甲醇。
CH3OH(g)+H2O(g) ΔH<0合成甲醇。① 在恒容密闭反应器中,H2的平衡转化率与温度、压强的关
系如图三所示,则A、B、C三点处对应平衡常数(KA、KB、KC)的
大小关系为 。

② 某高温下,将6molCO2和8molH2充入2L密闭容器中发生
反应,达到平衡后测得c(CO2)=2.0mol·L-1,则该温度下反应的平
衡常数值为 。