网址:http://m.1010jiajiao.com/timu3_id_381917[举报]
在20℃时,将一种可溶性盐与一种不溶物组成的固体混合物30g投入40g水中,充分搅拌溶解、过滤,尚余固体15.6g.此15.6g固体再加入40g水中充分搅拌溶解、过滤,还剩下5g,则该可溶性盐在20℃时的溶解度为
- A.26.5g
- B.31.25g
- C.36.0g
- D.无法计算
在20℃时,将一种可溶性盐与一种不溶物组成的固体混合物30g投入40g水中,充分搅拌溶解、过滤,尚余固体15.6g.此15.6g固体再加入40g水中充分搅拌溶解、过滤,还剩下5g,则该可溶性盐在20℃时的溶解度为
[ ]
 2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1(1)2NH3(g)
 N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。

⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。
(1)制备次氯酸钾强碱性饱和溶液:①在100mL水中溶解56gKOH,冷至室温后倒入三口瓶中(装置见右图),
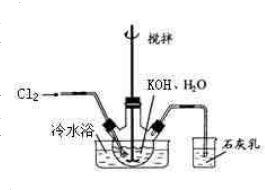 冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.
冷水浴冷却,通入Cl2,用电动搅拌器不断搅拌,直至溶液变为黄绿色且有少量白色晶体析出为止.②将饱和次氯酸钾倒入烧杯并置于冷水浴中.在不断搅拌下,分几次加入130gKOH固体.用玻璃砂芯漏斗过滤,弃去残渣(主要成分为KCl和少量KOH、KClO),得次氯酸钾强碱性饱和溶液.①石灰乳的作用是
②反应过程中和保存饱和次氯酸钾中用冷水浴冷却的原因是
 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O, 5KCl+KClO3+3H2O,
5KCl+KClO3+3H2O,③在上述制备过程中不断搅拌原因是
(2)合成高铁酸钾:将次氯酸钾饱和溶液转入烧杯,冷水浴冷却,在剧烈搅拌下分次加入13.5g研细的FeCl3?6H2O,立即产生大量紫黑色K2FeO4.加少量稳定剂Na2SiO3?9H2O和CuCl2?2H2O,反应30min后,分次加入100gKOH固体,保持温度在20℃以下,陈化30min,用玻璃砂芯漏斗抽滤,得高铁酸钾粗品.
①写出合成高铁酸钾的离子方程式
②13.53gFeCl3?6H2O理论上可制得高铁酸钾
(3)高铁酸钾的净水原理:①高铁酸钾在水中发生反应生成Fe(OH)3胶体.写出化学方程式
(16分)二氧化氯(ClO2)作为一种高效强氧化剂已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定,温度过高或水溶液中ClO2的质量分数高于30%等均有可能引起爆炸,易与碱液反应生成盐和水。
(1)某研究小组设计如图所示实验制备ClO2溶液,其反应的化学方程式为

 。
。
①在反应开始之前将烧杯中的水加热到80℃,然后停止加热,并使其温度保持在60~80℃之间。控制温度的目的是_ __,图示装置中缺少的一种必须的玻璃仪器是_____________。

②装置A用于溶解产生的二氧化氯气体,其中最好盛放_______(填字母)。
a.20mL 60℃的温水 b.100mL冰水
c.100mL饱和食盐水 d.100mL沸水
③在烧瓶中加入12.25g KClO3和9g草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热,反应后生成ClO2的质量为______________________
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子( )。饮用水中ClO2、
)。饮用水中ClO2、 的含量可用连续碘量法进行测定,实验步骤如下:
的含量可用连续碘量法进行测定,实验步骤如下:
步骤1:准确量取一定体积的水样加入锥形瓶中;
步骤2:调节水样的pH至7.0~8.0;
步骤3:加入足量的KI晶体;
步骤4:加入少量指示剂,用一定浓度的Na2S2O3溶液滴定至终点;
步骤5:再调节溶液的pH≤2.0;
步骤6:继续用相同浓度的Na2S2O3溶液滴定至终点。
①步骤1中若要量取20.00mL水样,则应选用的仪器是____________________________。
②步骤1~4的目的是测定水样中ClO2的含量,其反应的化学方程式为:

 ,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
,则步骤4中加入的指示剂为_________,滴定达到终点时溶液的颜色变化为___________________________。
③步骤5的目的是使 将溶液中的
将溶液中的 还原为
还原为 以测定其含量,该反应的离子方程式为_________________
_____________。
以测定其含量,该反应的离子方程式为_________________
_____________。
查看习题详情和答案>>