摘要: ①C ②a+c/2=
网址:http://m.1010jiajiao.com/timu3_id_381886[举报]
四种短周期的主族元素A、B、C、D在周期表中的位置如图所示。已知它们的原子序数之和为46,最外层电子数之和为22。试完成下列问题:

(1)D元素的阴离子的离子结构示意图为
(2)A、C、D的最高价氧化物所对应的水化物 酸性由强到弱的顺序是:
(3)用有关的方程式解释B元素的氢化物的水溶液的酸碱性:
(4)写出A单质与C的最高价氧化物对应水化物反应的化学方程式:
(5)请根据下面所给的5个热化学方程式,计算出反应④的反应热△H4= .
①NH3(g)+HCl(g)=NH4Cl(s);△H1=-176kJ?mol―1
②NH3(g)+H2O(l)=NH3?H2O(aq);△H2=-35.1kJ?mol―1
③HCl(g)+H2O(l)=HCl(aq);△H3=-72.3kJ?mol―1
④NH4Cl(s)+H2O(g)=NH4Cl(s);△H4=?kJ?mol―1
⑤NH3?H2O(g)+HCl(aq)=NH4Cl(aq)+H2O(l);△H5=-52.3kJ?mol―1
查看习题详情和答案>> 氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)右图是N2和H2反应生成2molNH3过程中能量变化示意图,每生成1molNH3放出热量为
46.1kJ
46.1kJ
;(2)在体积为2L的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)
 2NH3(g)△H<0,得到如下数据:
2NH3(g)△H<0,得到如下数据:| 实验组 | 温度/℃ | 起始量/mol | 2分钟/mol | 平衡常数 | |
| H2 | N2 | NH3 | |||
| 1 | 298 | 6 | 2 | 1.2 | 4.1×106 |
| 2 | 398 | 3 | 1 | 0.8 | K1 |
①反应的平衡常数表达式为
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
| [c(NH3)]2 |
| c(N2)[c(H2)]3 |
K1的相对大小,K1
<
<
4.1×106(填写“>”“=”或“<”);②实验1中以υ(H2) 表示的反应速率为
0.45mol/(L?min)
0.45mol/(L?min)
;③下列各项能作为判断该反应达到化学平衡状态的依据的是
C
C
(填序号字母);A.容器内N2、H2、NH3的物质的量浓度之比为1:3:2
B.υ(N2)(正)=3υ(H2)(逆)
C.容器内压强保持不变
D.混合气体的密度保持不变
(3)NH4Cl溶液呈酸性,这是由于NH4+水解的缘故.则NH4Cl在重水(D2O)中水解的离子方程式是
NH4++D2O NH3?HDO+D+
NH3?HDO+D+
 NH3?HDO+D+
NH3?HDO+D+NH4++D2O NH3?HDO+D+
NH3?HDO+D+
. NH3?HDO+D+
NH3?HDO+D+一定条件下,向装有固体催化剂且容积不变的密闭容器中通入1molN2和4molH2使之发生如下反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol 平衡时容器内气体压强为起始时的80%.
(1)通入1molN2和4molH2,达到平衡时,放出的热量为
(2)保持同一反应温度,在相同的容器中,将起始物质的量改为a mol N2、b mol H2、c mol NH3(a、b、c均不等于0),达到相同的平衡.
①(1)和(2)放出的热量值
A.一定相等 B.前者一定小 C.前者一定大 D.不能确定
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)
③欲使起始时反应表现为向正反应方向进行,a的取值范围是
查看习题详情和答案>>
(1)通入1molN2和4molH2,达到平衡时,放出的热量为
46.1kJ
46.1kJ
;(2)保持同一反应温度,在相同的容器中,将起始物质的量改为a mol N2、b mol H2、c mol NH3(a、b、c均不等于0),达到相同的平衡.
①(1)和(2)放出的热量值
C
C
(填序号)A.一定相等 B.前者一定小 C.前者一定大 D.不能确定
②a、b、c必须满足的关系是(一个用a、c表示,另一个用b、c表示)
a+0.5c=1,b+1.5c=4
a+0.5c=1,b+1.5c=4
③欲使起始时反应表现为向正反应方向进行,a的取值范围是
0.5<a≤1
0.5<a≤1
. Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.
Ⅰ.氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用.根据所学知识,据此完成下列要求.(1)如图是N2与H2反应过程中能量变化的示意图,写出该反应生成液态氨的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.(2)若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量.从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436.0kJ/mol,则N-H键的键能是
391.55
391.55
kJ/mol.Ⅱ.已知25℃、101kpa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ/mol) | -283.0 | -285.8 | -726.5 | -890.3 |
CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ?mol-1
| 3 |
| 2 |
CH3OH(l)+
O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ?mol-1
.| 3 |
| 2 |
(2)根据盖斯定律完成下列反应的热化学方程式:
CO(g)+2H2(g)═CH3OH(l)△H=
-128.1KJ/mol
-128.1KJ/mol
.(3)现有H2和CH4的混合气体112L(标准状况),使其完全燃烧生成CO2(g)和H2O(l),共放出热量3242.5kJ,则原混合气体中H2和CH4的物质的量之比是
D
D
.A.1:1B.1:3C.1:4D.2:3.
氢气是工业上重要的原料。
(1)氧气用于工业合成氨N2(g) +3H2(g) 2NH3(g);△H=-92.2 kJ/mol。
2NH3(g);△H=-92.2 kJ/mol。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4、t5、t7时刻所对应的实验条件改变分别是:
t4________,t5_______,t7_________
(1)氧气用于工业合成氨N2(g) +3H2(g)
 2NH3(g);△H=-92.2 kJ/mol。
2NH3(g);△H=-92.2 kJ/mol。①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4、t5、t7时刻所对应的实验条件改变分别是:
t4________,t5_______,t7_________

②温度为T℃时,将2amolH2和amolN2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%.此时放 出热量46. 1kJ。则该温度下反应的平衡常数为____________。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) +H2O(g)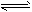 H2(g) +CO(g);△H=+131.3 kJ/mol
H2(g) +CO(g);△H=+131.3 kJ/mol
①该反应在低温下不能自发进行的原因是____________
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达平衡状态的有_________。
I.混合气体的密度;Ⅱ.容器内气体的压强;Ⅲ.混合气体的总物质的量;ⅣCO物质的量浓度。
A.只有Ⅳ
B.只有I和Ⅳ
C.只有Ⅱ和Ⅲ
D.I、Ⅲ和Ⅳ
E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423 K, 同时向A、B中分别加入amol及b mol碘化氢(a>b),待反应2HI(g) H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)A____c(I2)B;平衡时HI的分解率
H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)A____c(I2)B;平衡时HI的分解率
aA_________aB;平衡时H2在混合气体中的体积分数A ____B。(填写“>”“<”或“=”)
查看习题详情和答案>>
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) +H2O(g)
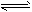 H2(g) +CO(g);△H=+131.3 kJ/mol
H2(g) +CO(g);△H=+131.3 kJ/mol ①该反应在低温下不能自发进行的原因是____________
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达平衡状态的有_________。
I.混合气体的密度;Ⅱ.容器内气体的压强;Ⅲ.混合气体的总物质的量;ⅣCO物质的量浓度。
A.只有Ⅳ
B.只有I和Ⅳ
C.只有Ⅱ和Ⅲ
D.I、Ⅲ和Ⅳ
E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423 K, 同时向A、B中分别加入amol及b mol碘化氢(a>b),待反应2HI(g)
 H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)A____c(I2)B;平衡时HI的分解率
H2(g)+I2(g)达到平衡后,平衡时I2的浓度c(I2)A____c(I2)B;平衡时HI的分解率aA_________aB;平衡时H2在混合气体中的体积分数A ____B。(填写“>”“<”或“=”)