网址:http://m.1010jiajiao.com/timu3_id_381491[举报]
(物质结构与性质)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1.请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的________(填序号):
①A单质>B单质>R;
②R>A单质>B单质;
③B单质>R>A单质;
④A单质>R>B单质.
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为________.
(3)写出D原子的核外电子排布式________,C的氢化物比D的氢化物在水中溶解度大得多的可能原因________.
(4)下图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为________,FeD2物质中具有的化学键类型为________.

有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A+与D2-离子数之比为2:1.
请回答下列问题:
(1)A元素形成的晶体属于A2密堆积型式,则其晶体内晶胞类型应属于
(填写“六方”、“面心立方”或“体心立方”).
(2)B-的电子排布式为
(3)C的氢化物的空间构型为
(4)B元素的电负性
(5)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm.试计算R晶体的密度为
| 312 |
| a3NA |
| 312 |
| a3NA |

《物质结构与性质》
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为 。
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
(1)写出A B C D元素符:A
(2)写出A的原子结构示意图:
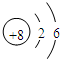
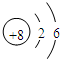


(3)分别写出B、D的最高价氧化物的水化物的化学式
(4)比较D的气态氢化物与H2S和HF的稳定性:
(5)用电子式表示B与D形成的化合物的过程:


(1)写出A B C D元素符:A
(2)写出A的原子结构示意图:




(3)分别写出B、D的最高价氧化物的水化物的化学式
(4)写出单质A与氢气反应的化学方程式:
| ||
| ||
(5)比较D的气态氢化物与H2S和HF的稳定性:
(6)用电子式表示B与D形成的化合物的过程:


(7)C与D两元素最高价氧化物的水化物反应的离子方程式