网址:http://m.1010jiajiao.com/timu3_id_381156[举报]
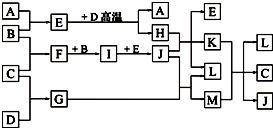 如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).
如图,常温下单质A、B为气体,单质C为固体,它们依次分别由短周期元素甲、乙、丙组成,甲元素原子核外电子数等于其电子层数,乙、丙同主族;E常温下为液体,G、H为黑色固体,D是常见金属(反应条件多数略去).回答下列问题:
(1)化合物E的沸点高于化合M的沸点,原因是
(2)甲、乙两种元素可以形成两种化合物,其中一种化合物含有4个原子核,该化合物的结构式为
(3)E与D高温反应的化学方程式为
(4)实验室在保存L溶液时,需加入少量D,理由是
(5)已知一定条件下,每1mol F与单质B完全反应生成I放出热量98.0kJ,若2mol F与1mol B在此条件下发生反应,达平衡时,放出热量为176.4kJ,则F的转化率为
①4mol F、2mol B ②2mol F、2mol B、2mol I
③1mol F、0.5mol B、1mol I ④3mol I、1mol Ne.

回答下列问题:
(1)化合物E、M的沸点____________高(填化学式),原因是_______________________。
(2)甲、乙两种元素还可以形成一种含有4个原子核和18个电子的化合物,该化合物的结构式为_________________________________。
(3)E与D高温反应的化学方程式为________________________,K与M在水溶液中反应的离子方程式为____________________________________________。
(4)实验室在保存L溶液时,需加入少量D,理由是________________________,实验室检验L的水溶液中的阳离子的方法是________________________________________。
(5)已知一定条件下每1 mol F与单质B完全反应生成I放热98.0 kJ,若2 mol F与1 mol B在此条件下发生反应,达平衡时,放出热量为176.4 kJ,则F的转化率为____________,平衡时F的物质的量为____________,若保持温度和压强不变(反应混合物都为气体)按下列四种配比作为起始物质充入,达到平衡时各物质的物质的量与上述平衡状态相同的是_______________。
A.4 mol F 2 mol B
B.2 mol F 1 mol B 2 mol I
C.1 mol F 0.5 mol B 1 mol I
D.3 mol I 1 mol Ne
查看习题详情和答案>>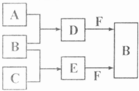 试回答:
试回答:(1)E的电子式是


(2)单质X和B或D均能反应生成黑色磁性固体Y,Y的化学式是
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等.Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18.Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是
(4)取0.3mol F与足量D充分混合后,所得溶液中再通入0.2mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+)
(5)E的大量排放会引发很多环境问题.有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用.25℃,101kPa时,该反应的热化学方程式是
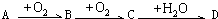 .以下推断不正确的是( )
.以下推断不正确的是( )| A、若A为溶于CS2的淡黄色固体单质,且D为强酸,则B通常用品红试剂来检验 | B、若A为喷泉实验常用的气体且其水溶液呈碱性,则D能与A反应制化肥 | C、若C为温室气体,则A与C在一定条件下反应可生成B | D、若B、C对环境造成的危害主要是光化学烟雾等,则A不可能是单质 |

(1)写出化学式:A 、D 、E 、X 。?
(2)在反应①~⑦中,不属于氧化还原反应的是 (填编号)。?
(3)反应⑥的离子方程式为 ;D除了可与F反应得到一种红色溶液外,还可与某有机物反应生成紫色物质,该有机物是(填名称) 。?
(4)反应⑦的化学方程式为 ;该反应中每消耗0.3 mol的A,可转移电子 mol。?
(5)写出D的溶液与小苏打溶液反应的离子方程式:?
。
查看习题详情和答案>>