摘要:7.将0.2mol/LCH3COOK与0.1 mol/L盐酸等体积混合后.溶液显酸性.溶液中下列微粒的物质的量浓度关系不正确的是 ( ) A.[H+]+[K+] = [CH3COO-]+[Cl-]+[OH-] B.[CH3COO-]+[ CH3COOH] =0.2mol/L C.[CH3COO-]> [ CH3COOH] D.[K+]> [CH3COO-]>[Cl-]>[ CH3COOH] >[H+]
网址:http://m.1010jiajiao.com/timu3_id_380873[举报]
将50mL 0.5mol/L NaCl溶液加水稀释到250mL,稀释后溶液中NaCl的物质的量浓度为( )
| A、0.1mol/L | B、0.2mol/L | C、0.3mol/L | D、0.4mol/L |
将0.2mol/L的HCN溶液和0.1mol/L的NaOH溶液等体积混合,所得混合溶液呈碱性,下列关系正确的是( )
| A、c(HCN)<c(CN-) | B、c(HCN)+c(CN-)=0.2mol/L | C、c(Na+)<c(CN-) | D、c(HCN)+2c(H+)=2c(OH-)+c(CN-) |
将2mol X和2mol Y充入2L密闭容器中发生如下反应:X(g)+3Y(g)  2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
 2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
2Z(g)+a Q(g);△H=b kJ/mol.达到平衡时生成0.8mol Z,测得Q的浓度为0.4mol/L,下列叙述正确的是( )
查看习题详情和答案>>
(选做题)(10分)在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)常温下,将0.2mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,若混合液体积等于两溶液体积之和,则混合液中下列关系正确的是____
A.c(HA)<c(A-) B.c(HA)一定大于0.1mol/L
C.c(Na+)=c(HA)+c(A-) D.2c(OH-)=2c(H+)+[c(HA)-c(A-)]
(2)常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液中含碳元素的各种微粒(CO2逸出未画)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填:“能”或“不能”) 大量共存。
②当pH=7时,溶液中各种离子其物质的量浓度的大小关系是:
。
③已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh= 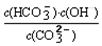 =2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。
=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=2︰1时,溶液的pH= 。