摘要:已知4CuO2Cu2O+O2↑.Cu2O+H2SO4=Cu+CuSO4+H2O.下列说法中正确的是( ) A.高温下Cu和O2反应生成Cu2O B.Cu2O可与过量浓硫酸反应生成Cu和CuSO4 C.高温下.CuO比Cu2O稳定 D.碱性溶液中CuSO4可氧化Cu生成Cu2O
网址:http://m.1010jiajiao.com/timu3_id_380782[举报]
(2008?佛山二模)最近,我国利用生产磷铵排放的废渣磷石膏制取硫酸并联产水泥的技术研究获得成功.已知磷灰石的主要成分是Ca3(PO4)2,具体生产磷铵流程如下:
回答下列问题:
(1)操作a的名称是
(2)装置a中生成两种酸式盐,它们的化学式分别是
(3)依题意猜测固体A中一定含有的物质的化学式是
(4)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是
(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.能用于测定硫酸尾气中SO2含量的是
A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.
查看习题详情和答案>>

回答下列问题:
(1)操作a的名称是
过滤
过滤
,实验室中进行此操作的非玻璃仪器或用品有铁架台(含铁圈)、滤纸
铁架台(含铁圈)、滤纸
;在实验室中操作b的名称是蒸发浓缩、冷却结晶
蒸发浓缩、冷却结晶
.(2)装置a中生成两种酸式盐,它们的化学式分别是
(NH4)2HPO4、NH4H2PO4
(NH4)2HPO4、NH4H2PO4
.(3)依题意猜测固体A中一定含有的物质的化学式是
CaSO4
CaSO4
(结晶水部分不写).(4)热交换器是实现冷热交换的装置.化学实验中也经常利用热交换来实现某种实验目的,气、液热交换时通常使用的仪器是
冷凝管
冷凝管
.(5)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.能用于测定硫酸尾气中SO2含量的是
BC
BC
.(选填字母)A.NaOH溶液、酚酞试液
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液.
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为
 ,B的结构式为
,B的结构式为
 .
.
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
(4)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式:
(5)Z2H4和ZO2是一种双组分火箭推进剂.两种物质混合发生反应生成Z2和X2O(g),已知8g气体Z2H4在上述反应中放出142kJ热量,其热化学方程式为
查看习题详情和答案>>
回答下列问题:
(1)L的元素符号为
O
O
;M在元素周期表中的位置为第三周第ⅢA族
第三周第ⅢA族
;五种元素的原子半径从大到小的顺序是Al>C>N>O>H
Al>C>N>O>H
(用元素符号表示).(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为




(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
34
34
.(4)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式:
NH4++OH-=NH3?H2O
NH4++OH-=NH3?H2O
.(5)Z2H4和ZO2是一种双组分火箭推进剂.两种物质混合发生反应生成Z2和X2O(g),已知8g气体Z2H4在上述反应中放出142kJ热量,其热化学方程式为
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136kJ/mol
.(2011?龙岩模拟)“分子筛”可作为催化剂、催化剂载体或吸附剂.以高岭土(主要成分为Al2O3、SiO2等)、石灰石、海水为原料生产“分子筛”的工艺流程如图所示.回答下列问题:
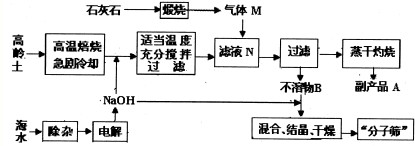
(1)海水中含Mg2+、Ca2+和SO2-4杂质.为制取NaOH,杂质离子必须除去.“除杂”时需按一定顺序加入下列试剂:①过量的NaOH溶液;②过量的Na2CO3溶液;③适量的盐酸;④过量的BaCl2溶液.正确的添加顺序是
(2)气体M(过量)和滤液N生成B的离子方程式是
(3)写出副产物A溶于水所得溶液中各离子浓度从大到小的顺序为
(4)上述流程中可以循环利用的物质是
(5)已知:某高岭土中Al2O3的质量分数为35%,则1t高岭土在理论上可制得化学式为Na2O?Al2O3?2SiO2?9/2H2O(Al2O3的质量分数为28%)的分子筛
查看习题详情和答案>>

(1)海水中含Mg2+、Ca2+和SO2-4杂质.为制取NaOH,杂质离子必须除去.“除杂”时需按一定顺序加入下列试剂:①过量的NaOH溶液;②过量的Na2CO3溶液;③适量的盐酸;④过量的BaCl2溶液.正确的添加顺序是
④①②③或①④②③;
④①②③或①④②③;
.要使Ca2+完全沉淀(即溶液中c(Ca2+)<1×10-5mol/L),溶液中c(CO2-3)应不小于2.9×10-4mol/L
2.9×10-4mol/L
已知 Ksp(CaCO3)=2.9×10-9).(2)气体M(过量)和滤液N生成B的离子方程式是
SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-;AlO2-+2H2O+CO2═Al(OH)3↓+HCO3-
.(3)写出副产物A溶于水所得溶液中各离子浓度从大到小的顺序为
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)>c(H+)
.(4)上述流程中可以循环利用的物质是
CO2
CO2
.(5)已知:某高岭土中Al2O3的质量分数为35%,则1t高岭土在理论上可制得化学式为Na2O?Al2O3?2SiO2?9/2H2O(Al2O3的质量分数为28%)的分子筛
1.25
1.25
t.