摘要:29. 有机物 A 在空气中完全燃烧只生成跳H2O 和 CO2,.取 6 . 80g 某液态有机物 A .置于 10.0 LO2中完全燃烧.产物经浓H2SO4吸收后.浓H2SO4 质量增加 5.4g .剩余气体经过 CaO吸收.气体体积又减少 5.6L .(所有体积均为标况下测定) (l) 6.80g A中C. H 物质的量之比为 . O的物质的量为 mol (2)由以上比例能否确定 A 的分子式 , (3)如果不能确定 A 的分子式.理由是 如果能确定 A 的分子式. A 为多元醇.且任意一个羟基被卤素原子取代后得到的一卤代物只有一种.则它的结构简式为 (III)1976 年压Inouep 报道用 Pd 的一磷化物催化二氧化碳和丁二烯反应.可得的产物之一是甲.若有机物甲与乙互为同分异构体.且乙能与 FeCl3溶液作用显紫色.乙的分子结构中不存在甲基.乙与适量的新制 Cu 2的悬浊液在加热条件下反应.可以产生砖红色的沉淀.则: ( l )有机物甲的分子式为 ( 2 )有机物乙含有的官能团是 . ( 3 )在一定条件下.能与 1 mol 乙起加成反应的 H2的最大用量为 mol ( 4 )符合上述条件的有机物乙有 种. ( 5 )若常温下与1 mol 乙起取代反应需耗 Br2的最大用量为 3mol.写出乙与适量的新制 Cu(OH )2的悬浊液在加热条件下反应的化学方程式: . 自贡市普通高中 2007 级二诊考试
网址:http://m.1010jiajiao.com/timu3_id_380775[举报]
2007年lO月24日l8时05分,就在这天与山、山与水的环拥之中,“嫦娥奔月”,一个流传了千年的神话,中国首颗探月卫星发射,在有着“月亮城”之称的高原航天城梦想成真.发射嫦娥一号卫星的长征三号甲运载火箭一二级常规燃料为液氧和液氢.下列有关说法不正确的 是( )
| A、液氧和液氢要分装加注到火箭燃料箱中 | B、氧气比氢气较易液化 | C、火箭一二级常规燃料燃烧产物对发射环境没有污染 | D、用液氧和液氢做火箭燃料,主要是因为氢气燃烧能放出大量的热量 |
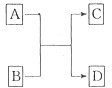 (2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:
(2013?江西模拟)(一)X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的二种元素,M是地壳中含量最高的金属元素.回答下列问题:(1)L的元素名称为
氧
氧
;五种元素的原子半径从小到大的顺序是(用元素符号表示)H<O<N<C<Al
H<O<N<C<Al
.(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程
3H?+ →
→
 →
→
3H?+ →
→
,B的结构式 →
→


(3)硒(Se)是人体必须的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
34
34
,其最高价氧化物对应的水化物化学式为H2SeO4
H2SeO4
.该族2~5周期元素单质分别与H2反应生成1mol气态氢化物的反应热如下,表示生成1mol硒化氢反应热的是b
b
(填字母代号).a.+99.7kJ?mol-1 b.+29.7kJ?mol-1c.-20.6kJ?mol-1 d.-241.8kJ?mol-1(4)一定条件下,M与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知.该反应生成lmol乙时放出536kJ热量,其热化学方程式为
4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)△M=-1072g/mol
4Al(s)+3TiO2(s)+3C(s,石墨)=2Al2O3(s)+3TiC(s)△M=-1072g/mol
.(二)已知A、B、C、D分别是由短周期元素原子组成的四种微粒,它们之间有如图所示的转变关系,且A是种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
.(2)若B、D属同主族的单质分子,写出C的化学式
H2O
H2O
.(3)若B是一种含四核l8电子的分子,如果D是一种气态单质分子,B的结构简式为
H-O-O-H
H-O-O-H
.(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
.(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有
CH3OH、CH3-CH3
CH3OH、CH3-CH3
(写出物质的化学式,如果是有机物则写相应的结构简式). 已知A、B、C、D四种物质分别是由短周期元素组成的微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:
已知A、B、C、D四种物质分别是由短周期元素组成的微粒,它们之间有如图所示的转化关系,且A是一种含有18电子的微粒,C是一种含有10电子的微粒.请完成下列各题:(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程式:
2F2+2H2O=4HF+O2
2F2+2H2O=4HF+O2
;(2)若B是一种四核含18电子的分子,D是一种气态单质分子,则A的化学式为
N2H4
N2H4
,B的结构式为H-O-O-H
H-O-O-H
;(3)若A、B均是含2个原子的微粒,其中B中含有10个电子,D中含有l8个电子,则A、B之间发生反应的离子方程式为
HS-+OH-=S2-+H2O
HS-+OH-=S2-+H2O
;(4)若D是一种含有22个电子的分子,则符合如图所示关系的A的物质有
CH3OH、CH3-CH3
CH3OH、CH3-CH3
(写化学式,如果是有机物则写相应的结构简式). [化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.
[化学--选修物质结构与性质]不锈钢以其优异的抗腐蚀性能越来越受到人们的青睐,它主要是由铁、铬、镍、铜、碳等元素所组成的合金.(1)写出Fe2+的核外电子排布式
(2)[cr(H2O)4Cl2]Cl?2H2O中cr的配位数为
(3)金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n,推测Ni(CO)n的晶体类型
(4)常温下,碳与氢以原子个数比1:1形成的气态氢化物中,其分子中的σ键和П键的数目比是
(5)铜是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途.CuH的晶体结构如右图所示,若CuH的密度为d g/cm3,阿伏加德罗常数的值为NA,则该晶胞的边长为
(6分)已知A、B、C、D分别是由短周期元素原子组成的四种微粒,它们之间有如图所示的转变关系,且A是种含有18电子的微粒,C是一种含有10电子的微粒。请完成下列各题:
(1)若A、D分别是两种气态单质分子,写出A与B反应的化学方程
式
(2)若B、D属同主族的单质分子,写出C的化学式
(3)若B是一种含四核l8电子的分子,如果D是一种气态单质分子,B的结构简式为 ;
(4)若A、B均是含2个原子核的微粒,其中B中含有10个电子,D中含有18个电子,则A、B之间发生的离子反应方程式为
(5)若D是一种含有22电子的分子,则符合如图关系的A的物质有 (写出物质的化学式,如果是有机物则写相应的结构简式)。