摘要:13.已知在某温度下.将 l md SO3充人一定容积的密闭容器中.反应达平衡时混合气体的压强比起始时增大了 20 %.若起始时充人 1 mol SO2和 lmol O2.在相同温度下建立平衡时.SO2的转化率为 A .20 % B.20 %-60 % C.60 % D.> 60 %
网址:http://m.1010jiajiao.com/timu3_id_380771[举报]
氯气是一种重要的氧化剂.
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是
(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是
查看习题详情和答案>>
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
| ||
MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
.若产生0.3mol Cl2,则消耗的还原剂的物质的量是
| ||
0.6mol
0.6mol
,反应中转移的电子数是0.6NA
0.6NA
.(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
,欲检验所得产物中的阳离子,操作方法和现象是:取少量含该产物的溶液,向其中滴加硫氰化钾溶液,溶液由黄色变为血红色
硫氰化钾溶液,溶液由黄色变为血红色
,则证明有该阳离子.(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是
1:4
1:4
.氯气是一种重要的氧化剂.
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是______.若产生0.3mol Cl2,则消耗的还原剂的物质的量是______,反应中转移的电子数是______.
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是______,欲检验所得产物中的阳离子,操作方法和现象是:取少量含该产物的溶液,向其中滴加______,则证明有该阳离子.
(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是______.
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是______.
查看习题详情和答案>>
氯气是一种重要的氧化剂.
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是______.若产生0.3mol Cl2,则消耗的还原剂的物质的量是______,反应中转移的电子数是______.
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是______,欲检验所得产物中的阳离子,操作方法和现象是:取少量含该产物的溶液,向其中滴加______,则证明有该阳离子.
(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是______.
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是______.
查看习题详情和答案>>
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是______.若产生0.3mol Cl2,则消耗的还原剂的物质的量是______,反应中转移的电子数是______.
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是______,欲检验所得产物中的阳离子,操作方法和现象是:取少量含该产物的溶液,向其中滴加______,则证明有该阳离子.
(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是______.
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是______.
氯气是一种重要的氧化剂.
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 .若产生0.3mol Cl2,则消耗的还原剂的物质的量是 ,反应中转移的电子数是 .
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是 ,欲检验所得产物中的阳离子,操作方法和现象是:取少量含该产物的溶液,向其中滴加 ,则证明有该阳离子.
(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是 .
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是 . 查看习题详情和答案>>
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 .若产生0.3mol Cl2,则消耗的还原剂的物质的量是 ,反应中转移的电子数是 .
(2)将氯气通入足量的氯化亚铁溶液中,反应的离子方程式是 ,欲检验所得产物中的阳离子,操作方法和现象是:取少量含该产物的溶液,向其中滴加 ,则证明有该阳离子.
(3)在常温下,NaOH溶液与氯气反应可制取漂白液,反应的离子方程式是 .
(4)已知在某温度下,将氯气通入烧碱液中,得到NaCl、NaClO和NaClO3的混合液.经测定,NaClO和NaClO3的物质的量之比为3:1,则反应中被氧化与被还原的氯元素的物质的量之比是 . 查看习题详情和答案>>
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
C+ K2Cr2O7+ ═ CO2↑+ K2SO4+ Cr2(SO4)3+ H2O
请完成并配平上述化学方程式.其中氧化剂是 ,氧化产物是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
O2(g)=CO2(g)△H2=-283kJ?mol-1
H2(g)+
O2(g)=H2O(g)△H3=-242kJ?mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为 ;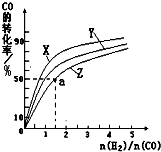
②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K= .
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
若5min~10min只改变了某一条件,所改变的条件是 ;且该条件所改变的量是 .
查看习题详情和答案>>
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应化学方程式为:
请完成并配平上述化学方程式.其中氧化剂是
(2)甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ?mol-1
①已知:CO(g)+
| 1 |
| 2 |
H2(g)+
| 1 |
| 2 |
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为

②在容积为1L的恒容容器中,分别研究在230℃、250℃、270℃三种温度下合成甲醇的规律.如图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系.
请回答:
ⅰ)在上述三种温度中,曲线Z对应的温度是
ⅱ)利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)?CH3OH(g)的平衡常数K=
③在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(mol?L-1)变化如下表所示:
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |