网址:http://m.1010jiajiao.com/timu3_id_380721[举报]
 x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:(1)v(B)=
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变.
(10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) = mol/(L·min),v(C) = mol/(L·min),x= 。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
查看习题详情和答案>>
(10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) = mol/(L·min),v(C) = mol/(L·min),x= 。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
(10分)t℃时,将3molA和2molB气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A (g)+B (g) 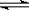 x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B) = mol/(L·min),v(C) = mol/(L·min),x= 。
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)= ;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是____________(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变
查看习题详情和答案>>

x C(g),2min时反应达到平衡状态(温度不变),剩余1.8molB,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)v(B)=______mol/(L?min),v(C)=______mol/(L?min),x=______.
(2)比较达到平衡时,A、B两反应物的转化率之比为α(A):α(B)=______;
(3)若继续向原平衡混合物的容器中通入少量氦气(氦气和A、B、C都不反应)后,下列说法中正确的是______(填写字母序号)
A.化学平衡向正反应方向移动 B.化学平衡向逆反应方向移动
C.化学平衡不会发生移动 D.正、逆反应的化学反应速率保持不变.