摘要: 如图所示.间距L=1m的足够长的光滑平行金属导轨与水平面成 30°角放置.导轨上端连有阻值为0.8Ω的电阻R和理想电流表.磁感应强度为B=1T的匀强磁场垂直导轨平面.现有质量m=l kg.电阻r=0.2Ω的金属棒.从导轨底端以10m/s的初速度v0沿平行导轨向上运动.现对金属棒施加一个平行于导轨平面向上且垂直于棒的外力F.保证棒在向上做匀减速运动的整个过程中.每1s内在电阻R上的电压总是均匀变化1.6V.取g=10m/s2. 求:(1)电流表读数的最大值, (2)从金属棒开始运动到电流表读数为零的过程中.棒的机械能如何变化.变化了多少? (3)请推导出外力F随金属棒在导轨上的位置(x)变化关系的表达式.
网址:http://m.1010jiajiao.com/timu3_id_380575[举报]
(2011?怀化一模)化学一化学与技术
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)
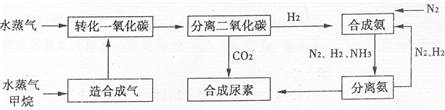
请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
②
(2)依据流程圈,判断下列说法正确的是
A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
.降低温度K减小,则正反应是一个
查看习题详情和答案>>
我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)

请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①
2NH3+CO2
NH2COONH4
| ||
2NH3+CO2
NH2COONH4
;
| ||
②
NH2COONH4
CO(NH2)2+H2O
| ||
NH2COONH4
CO(NH2)2+H2O
.
| ||
(2)依据流程圈,判断下列说法正确的是
C
C
.A.在转化CO的过程中使用催化剂,可以提高CO的转化率
B.进入分离二氧化碳装置的气体有2种
C.N2、H2的循环使用,提高了原子的利用率
D.二氧化碳与氨合成尿素属于人工固氮
E.流程中的原料有3种取之不尽,用之不完
(3)合成氨选择的外界条件是:催化剂,20~50MPa的压强,500℃的温度.选择该温度的主要原因是
500℃的温度反应速率较快,催化剂活性最高
500℃的温度反应速率较快,催化剂活性最高
.(4)已知制造合成气的反应为CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的平衡常数表达式为K=
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
吸
吸
热反应.当造合成气的反应中甲烷的转化率为75%.合成氨中氢气的转化率为40%(其他过程的损失不计)以5.60xlO7L甲烷为原料能够合成4.48xlO7L
4.48xlO7L
L氨气.(假设体积均在标准状况下测定)(2010?潮州二模)A、B、C、D、E、F和G都是有机化合物,它们的关系如图所示:

(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为
 ;
;
(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为
(3)反应①的化学方程式是
 ;
;
(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是
 ;
;
(5)E可能的结构简式是
 .
.
查看习题详情和答案>>

(1)化合物C的分子式是C7H8O,C遇到FeCl3溶液显紫色,C与溴水反应生成的一溴代物只有两种,则C的结构简式为


(2)D为一直链化合物,其相对分子质量比化合物C的小20,它能跟NaHCO3反应放出CO2,则D分子式为
C4H8O2
C4H8O2
,D具有的官能团是羧基
羧基
;(3)反应①的化学方程式是


(4)芳香化合物B是与A具有相同官能团的A的同分异构体,通过反应②化合物B能生成E和F,F可能的结构简式是


(5)E可能的结构简式是


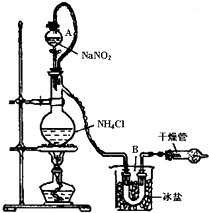 氯化铵是一种重要的化工原料,应用广泛.
氯化铵是一种重要的化工原料,应用广泛.(1)实验室通常用NH4Cl固体与Ca(OH)2固体混合共热制取氨气.
①写出实验室制取氨气的反应方程式
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
②浓氨水可以用来检验有毒气体氯气的泄漏,反应式为3Cl2+8NH3=N2+6NH4Cl,在该反应中,氧化剂是
Cl2
Cl2
(填化学式),检测时观察到的现象是有大量白烟产生
有大量白烟产生
,21.3g氯气能氧化氨气0.2
0.2
mol.(2)用浓氯化铵溶液处理的舞台幕布难着火,其原因是
B
B
(填字母).①幕布的着火点升高
②幕布的质量增加
③氯化铵分解吸收热量,降低了温度
④氯化铵分解产生的气体隔离了部分空气
A.①②B.③④C.①③D.②④
(3)实验室可用NH4Cl溶液与饱和的NaNO2溶液反应制取纯净的氮气,反应方程式为:NaNO2+NH4Cl
| ||
实验装置如图所示,试回答:
①装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是
c
c
(填写编号).a.防止饱和溶液蒸发
b.保证实验装置不漏气
c.使饱和NaNO2溶液容易滴下
②加热前必须进行的一个操作步骤是
检查气密性
检查气密性
.③收集N2最适宜的方法是
c
c
(填写编号)a.排空气法收集在集气瓶中
b.排水法收集在集气瓶中
c.直接收集在球胆或塑料袋中.
取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
查看习题详情和答案>>
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.( 1 )装置中有刻度的甲管可以用
碱式滴定管
碱式滴定管
代替 (填仪器名称),按图连接好装置后,检查装置气密性的方法是向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
向乙中注入适量的水,使乙中液面高于甲中液面,静止观察,若液面差保持不变,则气密性良好
( 2 )某实验小组用镁粉、盐酸、醋酸设计实验来证明:在同温同压下,当上述两种酸的物质的量相同时,与镁粉反应生成氢气的体积相同而反应速率不同.装置如图所示,
有关实验数据记录于下表:
| 酸溶液 | 酸溶液 | 气体体积/mL | 反应时间 | |
| (实验A) | (实验B) | (25℃、101 kPa) | 实验A | 实验B |
| CH3COOH0.1 mol/L40.00mL | HCl溶液 0.1 mol/L 40.00mL |
5 | t(a1)=155 s | t(b1)=7 s |
| 10 | t(a2)=310 s | t(b2)=16 s | ||
| 15 | t(a3)=465 s | t(b3)=30 s | ||
| 20 | t(a4)=665 s | t(b4)=54 s | ||
| … | … | … | ||
①每次实验至少需要用电子天平(能称准1mg) 称取镁粉
0.048
0.048
g;②冷却到25℃后,在读取气体体积时,首先应如何操作:
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
上下移动乙管,使甲管中液面和乙管中液面相平,再读数
;③分析实验数据,t(a1)远远大于t(b1)的原因是
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
开始阶段醋酸溶液中的c(H+)远小于相同浓度的盐酸中的c(H+)
.(3)用图示装置,某同学设计了测定镀锌铁皮镀层厚度的实验方案,将单侧面积为S cm2、质量为mg的镀锌铁皮与6mol?L-1 NaOH溶液反应.回答下列问题:(已知锌的密度为 ρ g/cm3)
①写出Zn镀层与NaOH溶液反应的离子方程式
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
Zn+2OH-+2H2O=Zn(OH)42-+H2↑
②为提高测定的准确性,需将锥形瓶上的单孔橡胶塞换为双孔橡胶塞,另一孔插入
分液漏斗
分液漏斗
(填仪器名称)实验时先向锥形瓶中加入镀锌铁皮样品,塞上双孔塞,再加入NaOH溶液;
③已知实验前后甲管中液面读数差为V mL(实验条件的气体摩尔体积为Vm mol?L-1).则镀锌铁皮的锌镀层厚度为
| 65V×10-3 |
| 2ρSVm |
| 65V×10-3 |
| 2ρSVm |