摘要:A.B.C.D四种短周期元素.原子序数依次增大.其核电荷总数和为38.B元素原子最外层电子数占其核外总电子数的3/4.C元素原子最外层电子是次外层电子数的1/4, D元素原子最外层电子比同周期C元素多5个电子,D和B不属于同一主族. (1) 写出元素符号: C .D . (2) A与B形成的化合物有 . (3) 用电子式表示C与D元素形成化合物的过程 . (4) B的单质和与C同周期的某元素的单质反应的生成物既能与强酸又能与强碱反应.请写出该生成物与强碱反应的离子方程式 . (5)D的单质在一定条件下可与一常见的金属反应.生成物溶于水的稀溶液呈蓝色.写出D单质与该金属反应的化学方程式 .
网址:http://m.1010jiajiao.com/timu3_id_380548[举报]
A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为1:1和1:2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题.
(1)写出元素符号:B
(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
(3)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
查看习题详情和答案>>
(1)写出元素符号:B
F
F
,DMg
Mg
.(2)A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2CO2═2Na2CO3+O2
.(3)B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为
c(Na+)>c(F-)>c(OH-)>c(H+)
c(Na+)>c(F-)>c(OH-)>c(H+)
.A、B、C、D四种短周期元素,原子序数依次增大而原子半径依次减小.A、B、D三种元素的最高价氧化物对应的水化物都能相互发生反应.B、C两原子的最外层电子数之和与D原子的最外层电子数相等.则下列说法中不正确的是( )
查看习题详情和答案>>
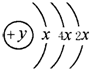 A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图如图,B元素最外层电子数是次外层电子数的四分之一,C元素的气态氢化物的水溶液显碱性,据此填空:(1)A元素气态氢化物的电子式
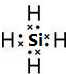
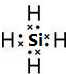
Mg>Si>P>N
Mg>Si>P>N
.(填元素符号)(2)A的最高价氧化物与氢氧化钠反应的离子方程式为
SiO2+2OH-=SiO32-+H2O
SiO2+2OH-=SiO32-+H2O
.(3)A,C,D的最高价氧化物对应水化物的酸性强弱
HNO3>H2SiO3>H3PO4
HNO3>H2SiO3>H3PO4
C的氢化物比D的氢化物沸点高
高
(填“高”或“低”),原因是NH3分子之间存在氢键,故其沸点比PH3的沸点高
NH3分子之间存在氢键,故其沸点比PH3的沸点高
.A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍.A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物.C+具有与氖原子相同核外电子排布.D原子最外层电子数比B原子最外层电子数多一个电子,根据以上条件,判断:
(1)四种元素分别是(写元素符号) A
(2)用电子式写出A2B化合物的形成过程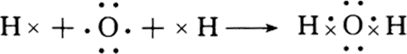
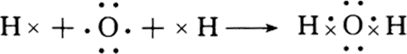 ; 用电子式写出C2B化合物的形成过程
; 用电子式写出C2B化合物的形成过程
 ;
;
(3)A2B2中加少量MnO2反应的化学方程式
查看习题详情和答案>>
(1)四种元素分别是(写元素符号) A
H
H
BO
O
CNa
Na
DCl
Cl
(2)用电子式写出A2B化合物的形成过程
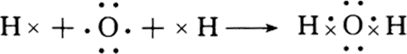
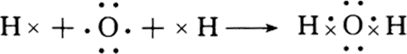


(3)A2B2中加少量MnO2反应的化学方程式
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;C2B2与CO2反应的化学方程
| ||
2Na2O2+2CO2═2Na2CO3+O2↑
2Na2O2+2CO2═2Na2CO3+O2↑
. ,B、C可形成离子化合物B3C2,据此填空:
,B、C可形成离子化合物B3C2,据此填空: