网址:http://m.1010jiajiao.com/timu3_id_380498[举报]
实验室利用右图所示装置制取乙酸异戊酯,其合成过程为:

①向圆底烧瓶中加入几粒碎瓷片,并注入0.14 mol异戊醇和0.35 mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集135 ℃—143 ℃之间的馏分。
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为
_____________________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是__________________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是________________________________________________。
查看习题详情和答案>>实验室利用右图所示装置制取乙酸异戊酯,其合成过程为:

①向圆底烧瓶中加入几粒碎瓷片,并注入0.14mol异戊醇和0.35mol冰醋酸,再加入4 mL浓H2SO4至不再分层。
②在烧瓶上安装冷凝回流装置,加热混合物1小时后,冷却至室温。
③把混合物转至分液漏斗中,加少量蒸馏水,振荡分层后除去水层,再用蒸馏水洗涤有机层。
④用5%的NaHCO3溶液分几次洗涤产品直至中性。
⑤向上述溶液中加NaCl晶体,搅拌静置,对液体进行分液。
⑥将粗产品转至蒸馏烧瓶中,加入碎瓷片,并加适量无水MgSO4或Mg(NO3)2蒸馏,收集135 ℃—143 ℃之间的馏分。
试完成下列问题:
(1)冷凝管中冷却水流向是由_____________进入,由____________流出。(填“A”或“B”)
(2)圆底烧瓶中的物质_______________(填“会”或“不会”)从冷凝管上口跑掉,是因为
_____________________________________________________________________________。
(3)合成实验中浓H2SO4的作用是____________________________________________,碎瓷片的作用是__________________________________________________________________。
(4)乙酸与异戊醇的物质的量之比0.35∶0.14>1∶1的原因是_______________________。
(5)在③中用蒸馏水多次洗涤的作用是_______________________________________。④中用NaHCO3溶液洗涤产品的作用是________________________________________________。
查看习题详情和答案>>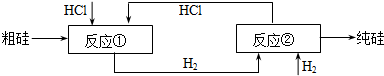
反应①:Si(粗)+3HCl(g)
| ||
反应②:SiHCl3+H2
| ||
(1)制备三氯氢硅的反应为:Si(s)+3HCl(g)═SiHCl3(g)+H2(g);△H=-210kJ?mol-1.伴随的副反应有:Si(s)+4HCl(g)═SiCl4(g)+2H2(g);△H=-241kJ?mol-1.SiCl4在一定条件下与H2反应可转化为SiHCl3,反应的热化学方程式为:SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g);△H=
(2)假设在每一轮次的投料生产中,硅元素没有损失,反应①HCl中的利用率为75%,反应②中和H2的利用率为80%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
(3)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法.工业上广泛采用的合成硅烷方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,化学方程式是
整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为
整个系统还必须与氧隔绝,其原因是
(4)若将硅棒与铁棒用导线相连浸在氢氧化钠溶液中构成原电池,则负极的电极反应式为:
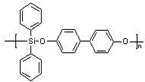
(5)硅能用于合成硅橡胶,右图是硅橡胶中的一种,其主要优点是玻璃化温度低,耐辐射性能好,则该硅橡胶的化学式为