摘要:10.D 11.A
网址:http://m.1010jiajiao.com/timu3_id_380461[举报]
Ⅰ.A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增.
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是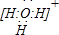
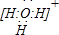 .
.
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为
 ,其中心原子的杂化类型为
,其中心原子的杂化类型为
(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程

(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
(6)请写出Z的原子核外电子排布式
查看习题详情和答案>>
已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成离子化合物.
请回答:
(1)A、D形成的三原子分子中心原子杂化类型是
sp3
sp3
,分子空间构型为三角锥
三角锥
,其电子式为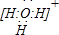
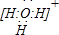
(2)元素A、D、F形成的原子数之比为1:1:1的化合物的电子式为


sp3
sp3
,VSEPR模型空间构型为四面体型
四面体型
.(3)请用电子式表示D、E原子个数比为1:1的化合物的形成过程


(4)在B原子与A形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称
丙烷
丙烷
,A、B、D元素的原子也可以共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式CO2+CO32-+H2O═2HCO3-
CO2+CO32-+H2O═2HCO3-
Ⅱ.某合金由 X、Y、Z三种元素组成,这三种元素位于周期表中前四周期,X是主要成分元素,X的基态原子中有4个未成对电子.Y的含量不低于11%,否则不能生成致密氧化膜YO3防止腐蚀,Y与X同周期,且原子核外未成对电子数最多.Z位于周期表中第4行、第10列.
(5)请写出X、Y、Z的元素符号及原子序数X
Fe、26
Fe、26
、YCr、24
Cr、24
ZNi、28
Ni、28
.(6)请写出Z的原子核外电子排布式
[Ar]3d84s2
[Ar]3d84s2
,X元素在周期表中的位置第四周期第Ⅷ族
第四周期第Ⅷ族
.A、B、C、D四种短周期元素原子序数依次增大,A元素原子的价电子排列为ns2np2,B元素的最外层电子数是其电子层数的3倍,E元素原子的价电子排布为3d64s2.C、D的电离能数据如下(kJ?mol-1):
(1)化合价是元素的一种性质.由C、D的电离能数据判断,C通常显
(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供
(5)如图所示晶胞中,阳离子与阴离子的个数为
查看习题详情和答案>>
| I1 | I2 | I3 | I4 | |
| C | 738 | 1451 | 7733 | 10540 |
| D | 577 | 1817 | 2745 | 11578 |
+2
+2
价,D显+3
+3
价;(2)某单质甲分子与化合物AB分子中电子总数相等,则甲分子中包含
1
1
个σ键,2
2
个π键;(3)AB的总键能大于甲的总键能,但AB比甲容易参加化学反应.根据下表数据,说明AB比甲活泼的原因是
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
断裂C≡O中的一个π键消耗的能量是273kJ/mol,断裂N≡N中的一个π键消耗的能量是523.3kJ/mol,断裂一个π键CO比N2更容易,所以CO更活泼
.| 单键 | 双键 | 叁键 | ||
| AB | 键能(kJ?mol-1) | 357.7 | 798.9 | 1071.9 |
| 甲 | 键能(kJ?mol-1) | 154.8 | 418.4 | 941.7 |
 (4)E能与AB形成配合物,其中E提供
(4)E能与AB形成配合物,其中E提供空轨道
空轨道
,AB提供孤对电子
孤对电子
.(5)如图所示晶胞中,阳离子与阴离子的个数为
3:1
3:1
.A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C 元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3.
(1)写出下列元素符号:
A
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:

(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:
(4)比较C、D的最高价氧化物的水化物的酸性:
查看习题详情和答案>>
(1)写出下列元素符号:
A
Na
Na
;BAl
Al
;CSi
Si
;DP
P
;ECl
Cl
.(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:


(3)写出A、B两元素最高价氧化物的水化物相互反应的化学方程式:
Al(OH)3+NaOH═NaAlO2+2H2O
Al(OH)3+NaOH═NaAlO2+2H2O
.(4)比较C、D的最高价氧化物的水化物的酸性:
H3PO4>H2SiO3
H3PO4>H2SiO3
(用化学式表示)Ⅰ.现有标准状况下的以下物质:
A.11.2LO2 B.6.8gNH3 C.1.204×1024CH4 D.0.5molCO2;
其中质量由大到小的顺序为
Ⅱ.相同质量的CO和CO2,其物质的量之比为
查看习题详情和答案>>
A.11.2LO2 B.6.8gNH3 C.1.204×1024CH4 D.0.5molCO2;
其中质量由大到小的顺序为
C>D>A>B
C>D>A>B
,各物质所含原子数由大到小的顺序是C>B>D>A
C>B>D>A
,其体积由大到小的顺序是C>A=D>B
C>A=D>B
,气体的密度由大到小的顺序是D>A>B>C
D>A>B>C
.(填序号)Ⅱ.相同质量的CO和CO2,其物质的量之比为
11:7
11:7
,所含的氧原子个数比为11:14
11:14
,所含碳元素的质量比为11:7
11:7
,相同条件下的体积比为11:7
11:7
.Ⅰ.已知氢氟酸、醋酸、氢氰酸(HCN)、碳酸在室温下的电离常数分别为:
根据上述数据,回答下列问题:
(1)四种酸中酸性最强的是
(2)写出H2CO3电离方程式是
(3)写出下列反应的化学方程式:足量的氢氟酸与碳酸钠溶液混合:
Ⅱ.氨水中存在:NH3?H2O?NH4++OH-,在5份0.01mol?L-1的氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量NaOH固体 D.少量浓硫酸 E.NH4Cl固体
按照要求填空:
(1)电离平衡会向正向移动是
(2)c(NH4+)、c(OH-)都增大的是
(3)c(NH4+)增大,c(OH-)减小的是
查看习题详情和答案>>
| ① | HF | Ka=6.8×10-4 mol?L-1 |
| ② | CH3COOH | Ka=1.7×10-5 mol?L-1 |
| ③ | HCN | Ka=6.2×10-10 mol?L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol?L-1 Ka2=4.7×10-11 mol?L-1 |
(1)四种酸中酸性最强的是
HF
HF
,四种酸中酸性最弱的是HCN
HCN
.(2)写出H2CO3电离方程式是
H2CO3?HCO3-+H+
H2CO3?HCO3-+H+
、HCO3-?CO32-+H+
HCO3-?CO32-+H+
.(3)写出下列反应的化学方程式:足量的氢氟酸与碳酸钠溶液混合:
2HF+Na2CO3═2NaF+H2O+CO2↑
2HF+Na2CO3═2NaF+H2O+CO2↑
;足量的CO2通入NaCN溶液中:NaCN+H2O+CO2═HCN+NaHCO3
NaCN+H2O+CO2═HCN+NaHCO3
.Ⅱ.氨水中存在:NH3?H2O?NH4++OH-,在5份0.01mol?L-1的氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量NaOH固体 D.少量浓硫酸 E.NH4Cl固体
按照要求填空:
(1)电离平衡会向正向移动是
ABD
ABD
;电离平衡会向逆向移动是CE
CE
.(2)c(NH4+)、c(OH-)都增大的是
A
A
;c(NH4+)、c(OH-)都较小的是B
B
.(3)c(NH4+)增大,c(OH-)减小的是
E
E
;c(NH4+)减小,c(OH-)增大的是C
C
.