网址:http://m.1010jiajiao.com/timu3_id_380430[举报]
(1)______________________叫热化学方程式。热化学方程式不仅表明了化学反应中的___________变化,也表明了化学反应中的___________变化。
(2)热化学方程式各物质前的化学计量数只表示___________,不表示___________,因此,它可以是___________数,也可以是___________数。对于相同物质的反应,当化学计量数不同时,其ΔH___________。
(3)请解释下述热化学方程式表示的含义。
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
若将此化学方程式中各物质的化学计量数均乘以2,热化学方程式应如何写?
_____________________________________________________________________
查看习题详情和答案>>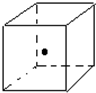 键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.参考以下表格的键能数据,回答下列问题:| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
SiC
(2)能不能根据键能的数据判断单质Si和化合物SiCl4的熔点高低?
(3)如图立方体中心的“?”表示金刚石晶体中的一个原子,请在立方体的顶点用“?”表示出与之紧邻的碳原子

(4)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)
| 高温 |
 能源的开发利用与人类社会的可持续性发展息息相关.
能源的开发利用与人类社会的可持续性发展息息相关.I已知:Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)△H1=akJ?mol-1
CO(g)+
| 1 |
| 2 |
4Fe(s)+3O2(g)=2Fe2O3(s)△H3=ckJ?mol-1
则C的燃烧热
II(I)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+C02(g)=2C0(g)
B.Na0H(aq)+HCl(aq)=NaCl(aq)+H20(1)
C.2H20(l)=2H2(g)+02(g)
D.2C0(g)+02(g)=2C02(g)
若以熔融的K2CO3与CO2为反应的环境,依据所选反应设计成一个原电池,诸写出该原电池的负极反应:
(2)某实验小组模拟工业合成氨反应N2+3H2
| 高温、高压 |
| 催化剂 |
| P |
| P0 |
①反应达平衡的标志是(填字母代号)
A.压强保持不变
B.气体密度保持不变
C.NH3的生成速率是N2的生成速率的2倍
②2min时,以C(N2)变化表示的平均反应速率为
③若提高N2的转化率可采取的措施有
A.向体系中按体积比1:1再充入N2和H2 B.分离出NH3
C.升高温度 D.充入He气使压强增大 E.加入一定量的N2
(3)25°C时,BaCO3和BaSO4的溶度积常数分别是8×10-9和1×10-10,某含有BaCO3沉淀的悬浊液中,c(C
| O | 2- 3 |
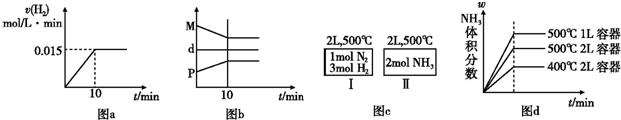
| A、若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图a所示 | B、反应过程中,混合气体平均相对分子质量为M,混合气体密度为d,混合气体压强为P,三者关系如图b | C、如图c所示,容器Ⅰ和Ⅱ达到平衡时,NH3的体积分数为ω,则容器Ⅰ放出热量与容器Ⅱ吸收热量之和为92.4 kJ | D、若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图d所示 |
(6分)键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的化学键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/KJ.mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“>”“<”)
SiC_______Si; SiCl4_______SiO2
(2)能否根据键能的数据判断单质Si晶体和化合物SiCl4的熔点高低? (填“能”或“不能”)原因是:
(3)![]() 工业上高纯硅可通过下列反应制取:
工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g) Si(s)+4HCl(g)
计算该反应的反应热△H为 。
选做题:26—27两题任选做一题,若全做按26题计分。
查看习题详情和答案>>