网址:http://m.1010jiajiao.com/timu3_id_380342[举报]
下面是某中学化学兴趣小组在25℃时测定一系列浓度氨水的pH所对应的c(OH-):
[仪器与试剂]酸度计、50mL碱式滴定管、100mL烧杯、0.10mol?L-1 氨水
[实验数据](不必填表格)
| 烧杯号 | V氨水 (mL) | V水(mL) | c (NH3?H2O) (mol?L-1) | c(OH-) | Kb | α |
| 1 | 50.00 | 0.00 | 1.34×10-3 | |||
| 2 | 25.00 | 25.00 | 9.48×10-4 | |||
| 3 | 5.00 | 45.00 | 4.24×10-4 |
(1)25℃时,氨水的电离常数:Kb≈______,通过计算所得的数据和简洁的文字说明电离常数、电离度与弱电解质的初始浓度的关系______
(2)用0.10mol?L-1盐酸分别滴定20.00mL0.10mol?L-1的NaOH溶液和20.00mL0.10mol?L-1氨水所得的滴定曲线如下:
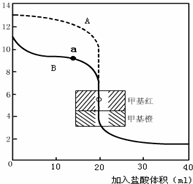
请指出盐酸滴定氨水的曲线为______(填A或B),请写出曲线a点所对应的溶液中各离子浓度由大到小的排列顺序______.
(3)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧试验机中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1=______.
(4)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料.其总反应式为4NH3+3O2=2N2+6H2O,正极上的电极反应式为O2+
2H2O+4e-=4OH-,则负极上的电极反应式为______.
某学习兴趣小组探究废干电池(锌筒内填有炭粉、MnO2、NH4Cl等的糊状物)的回收利用,并用回收的物质进行如下实验。
I.(1)从废干电池中提取NH4Cl。
① 利用该糊状物提取NH4Cl前两步的操作为:a.溶解 b. 。
② 甲同学设想:将分离出的NH4Cl溶液蒸发、结晶、灼烧,就可以制得纯净的NH4Cl。请对甲同学的方案作出评价并说明理由:______________________________________
。
(2)制取氨气。
① 乙同学要制备并收集到纯净的氨气,下列各反应及操作中合理的是
a.将氯化铵固体加热分解 b.将浓氨水滴入氢氧化钠固体中
c.将氢氧化钠固体加入浓氨水中 d.将氯化铵浓溶液滴入氢氧化钠固体中
② 乙同学认为将集气瓶正放在桌上(如图所示),就可以收集到纯净的氨气。

你若认为可行,请说明其操作:_____________________________。
你若认为不可行,请说明其理由:___________________________。
Ⅱ.丙同学利用上面得到的氨气制取氨水并进行了如下探究实验:
(3)为探究NH3?H2O是否是弱电解质。
丙同学设计方案如下:① 将1.12L(标况)NH3完全溶于水,配得溶液500mL;
② ;③分析数据,即
可得出结论。
请把最简单的实验步骤②,填写在上面的空格中。
(4)探究氨水与盐酸的反应过程。
丙同学进行了如下实验:向25mL上述氨水中逐滴滴加同浓度的盐酸,测定反应过程中溶液pH并绘制其pH变化曲线(如图)。请回答:

①酸碱恰好完全中和时的pH点应是_________
(填A或B或D),此时溶液中c(NH3?H2O)+c(NH4+)=______mol?L-1,溶液中
各离子的浓度由大到小的顺序为 。
III.请参与探究
(5)请完成以下探究实验报告。
【探究课题】比较在25℃、0.1mol?L-1的NH3?H2O溶液和0.1mol?L-1的NH4Cl溶液中,NH3?H2O的电离程度与NH4+水解程度的相对大小。
【探究方案】
查看习题详情和答案>>亚硝酸钠(NaNO2)是重要的防腐剂。某化学兴趣小组尝试制备亚硝酸钠,查阅资料:①HNO2为弱酸,在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
探究一 亚硝酸钠固体的制备
以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(反应方程式为2NO+Na2O2=2NaNO2,部分夹持装置和A中加热装置已略)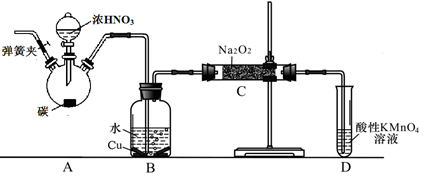
(1)写出装置A烧瓶中发生反应的化学方程式 。
(2)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂应是 (填字母)。
A.浓H2SO4 B.碱石灰 C.无水CaCl2
探究二 亚硝酸钠固体含量的测定及性质验证
称取装置C中反应后的固体4.000g溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000
mol/L酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
(3)第一组实验数据出现异常,造成这种异常的原因可能是 (填字母)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
(4)根据表中数据,计算所得固体中亚硝酸钠的质量分数 。
(5)亚硝酸钠易溶于水,将0.2mol·L-1的亚硝酸钠溶液和0.1mol·L-1的盐酸等体积混合,混合后溶液呈酸性,则混合后溶液中离子浓度由大到小的顺序为 。
探究三 反应废液的处理
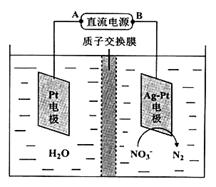
反应后烧瓶A中仍然存在一定量的硝酸,不能直接排放,用NaOH溶液调成中性,再用电化学降解法进行处理。25℃时,反应进行10min,溶液的pH由7变为12。电化学降解NO3-的原理如右图所示。
(6)电源正极为 (填A或B),阴极反应式为 。
 查看习题详情和答案>>
查看习题详情和答案>>