网址:http://m.1010jiajiao.com/timu3_id_380306[举报]
二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3;2SO2(g)+O2(g)![]() 2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
2SO3(g)某温度下,SO2的平衡化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题。
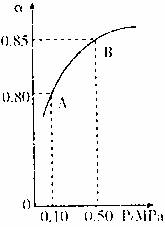
①平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列选项中有利于提高SO2平衡转化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强
D.减小压强 E.加入催化剂 F.移出氧气
③SO2尾气用Na2SO3溶液吸收可得到重要化工原料,反应的化学方程式为
;上述反应产物的水溶液呈酸性,原因 。
④工业制硫酸中SO2的一种制法是煅烧FeS2制取,煅烧FeS2的产物之一Fe3O4溶于H2SO4后,加入Fe粉可制取FeSO4,酸溶过程需保持溶液足够酸性,其原因是
。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
若用标准状况下4.48L CH4还原NO2至N2的整个过程中转移的电子总数为
(阿伏加德罗常的值用NA表示),写出上述反应的热化学方程式:
。
查看习题详情和答案>>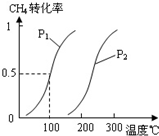 A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:
A、B、C、D、E、W均为短周期元素,原子序数依次增大.回答下列问题:(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式:
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g).将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如图.
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1
③在其它条件不变的情况下降低温度,逆反应速率将
(3)由A、C、D元素原子组成的化合物N2H4和H2O2有广泛的用途.
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液.电池放电时,负极的电极反应式为
②已知:16g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75KJ的热量.
H2O(1)=H2O(g)△H=+44kJ?mol-1
2H2O2(1)=2H2O(1)+O2(g)△H=-196.4kJ?mol-1
写出N2H4(肼)与氧气反应的热化学方程式为
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
或N2H4(1)+O2(g)=N2+2H2O(g)△H=-533.1kJ?mol-1
(15分)A、B、C、D、E、W均为短周期元素,原子序数依次增大。回答下列问题:
(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式: 。
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(3)由A、C、D元素原子组成的化合物N2H4和H2O2 有广泛的用途。
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。电池放电时,负极的电极反应式为 。
②已知:16 g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75 KJ的热量。 H2O(1)=H2O(g) △H=+44 kJ·mol-1
2H2O2(1)=2H2O(1)+O2(g) △H=-196.4 kJ·mol-1
写出N2H4(肼)与氧气反应的热化学方程式为 。
查看习题详情和答案>>
(15分)A、B、C、D、E、W均为短周期元素,原子序数依次增大。回答下列问题:
(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式: 。
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。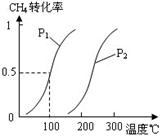
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(3)由A、C、D元素原子组成的化合物N2H4和H2O2 有广泛的用途。
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。电池放电时,负极的电极反应式为 。
②已知:16 g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75 KJ的热量。 H2O(1)=H2O(g) △H="+44" kJ·mol-1
2H2O2(1)=2H2O(1)+O2(g) △H=-196.4 kJ·mol-1
写出N2H4(肼)与氧气反应的热化学方程式为 。
(15分)A、B、C、D、E、W均为短周期元素,原子序数依次增大。回答下列问题:
(1)E单质为双原子分子,气体E的密度3.17g.L-1(标准状况),写出用石灰水吸收E反应的离子方程式: 。
(2)由A、B、D元素原子组成的化合物CH4和H2O在一定条件下发生反应:CH4(g)+H2O(g)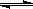 CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g) 。将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),达到平衡时,CH4的转化率与温度、压强的关系如右图。
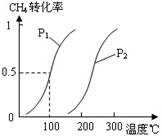
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数为 。
③在其它条件不变的情况下降低温度,逆反应速率将 (填“增大”、“减小”或“不变”)。
(3)由A、C、D元素原子组成的化合物N2H4和H2O2 有广泛的用途 。
①N2H4(肼)一空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的氢氧化钾溶液。电池放电时,负极的电极反应式为 。
②已知:16 g液态N2H4(肼)与足量过氧化氢反应生成氮气和水蒸气,放出320.75 KJ的热量。 H2O(1)=H2O(g) △H=+44 kJ·mol-1
2H2O2(1)=2H2O(1)+O2(g) △H=-196.4 kJ·mol-1
写出N2H4(肼)与氧气反应的热化学方程式为 。
查看习题详情和答案>>