摘要:10.与Fe3O4相似.Pb3O4可以看作Pb的两种氧化物结合成的化合物.也可以看作是盐.已知Pb是ⅣA族元素.则Pb3O4也可写作为 A.PbO·Pb2O3 B.Pb(PbO2)2 C.2PbO·PbO2 D.Pb2PbO4
网址:http://m.1010jiajiao.com/timu3_id_380179[举报]
铁、铜及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS2,其中S为-1价)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2
6SO2+Fe3O4,氧化产物为
(2)与明矾相似,硫酸铁也可用作净水剂.某自来水厂用氯气和绿矾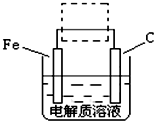 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为
(3)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在右图虚线框内作出修改,并用箭头标出电子流动方向.
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式
(4)高铁酸钾(K2FeO4)可用作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为
3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
该电池放电时正极反应式为
用该电池电解100mL 1mol?L-1的AgNO3溶液,当电路中通过0.1mol 电子时,被电解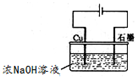 溶液的pH为
溶液的pH为
(5)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂.
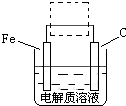
用右图装置可制得氧化亚铜,试写出阳极的电极反应式
查看习题详情和答案>>
(1)黄铁矿(FeS2,其中S为-1价)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为3FeS2+8O2
| ||
SO2、Fe3O4
SO2、Fe3O4
,若有3mol FeS2参加反应,转移电子的物质的量为32mol
32mol
.(2)与明矾相似,硫酸铁也可用作净水剂.某自来水厂用氯气和绿矾
 (FeSO4?7H2O)一起净水,其原理为
(FeSO4?7H2O)一起净水,其原理为Cl2+2Fe2+=2Fe3++2Cl-
Fe3++3H2O?Fe(OH)3(胶体)+3H+
Fe3++3H2O?Fe(OH)3(胶体)+3H+
Cl2+2Fe2+=2Fe3++2Cl-
Fe3++3H2O?Fe(OH)3(胶体)+3H+
(用离子方程式表示).Fe3++3H2O?Fe(OH)3(胶体)+3H+
(3)①钢铁的电化腐蚀简单示意图如右,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在右图虚线框内作出修改,并用箭头标出电子流动方向.
②写出修改前的钢铁吸氧腐蚀石墨电极的电极反应式
O2+2H2O+4e-=4OH-,
O2+2H2O+4e-=4OH-,
.(4)高铁酸钾(K2FeO4)可用作净水剂,也可用于制造高铁电池.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为
3Zn+2K2FeO4+8H2O
 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH该电池放电时正极反应式为
2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-
2FeO42-+8H2O+6e-=2Fe(OH)3+10OH-
.用该电池电解100mL 1mol?L-1的AgNO3溶液,当电路中通过0.1mol 电子时,被电解
 溶液的pH为
溶液的pH为0
0
(溶液体积变化忽略不计).(5)氧化亚铜是一种半导体材料,常用作制造整流器的材料,还可以用于光照条件下水分解的催化剂和农作物的杀菌剂.
用右图装置可制得氧化亚铜,试写出阳极的电极反应式
2Cu-2e-+2OH-=Cu2O+H2O
2Cu-2e-+2OH-=Cu2O+H2O
. 第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:
第ⅢA、VA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型第三代半导体材料,其晶体结构与单晶硅相似.试回答:(1)Ga的基态原子的价电子的轨道排布式为
1s22s22p63d104s24p1
1s22s22p63d104s24p1
.(2)下列说法正确的是
AC
AC
(选填序号).A.砷和镓都属于p区元素 B.GaN、GaP、GaAs均为分子晶体
C.电负性:As>Ga D.第一电离能Ga>As
(3)GaAs是由(CH3)3Ga和AsH3在一定条件下制得,同时得到另一物质,该物质分子是
非极性分子
非极性分子
(填“极性分子”或“非极性分子”).(CH3)3Ga中镓原子的杂化方式为sp2
sp2
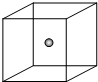
.(4)如图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
已知A是一种液态非金属单质的水溶液,B是由三种短周期元素组成的分子,相对分子质量为60,其结构与F相似,F是造成温室效应的主要气体,C是一种最常见的无色液体,G是具有臭鸡蛋气味的气体,K、N是非金属单质,J是一种淡食色粉末,③、④是工业生产中的重要反应.它们的关系如图.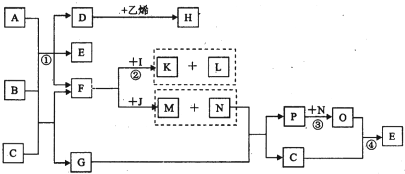
试回答下列问题:
(1)B的电子式为 ;H的结构简式为
(2)反应②的化学方程式为 ;工业上反应④的生产设备是 .
(3)在常温下条件下,1mol F与J完全反应,放出a kJ的热量,则该反应的热化学方程式为
(4)已知C的沸点比G高,其原因是
(5)将过量P通入M的溶液中生成F,发生反应的离子方程式为 .
(6)反应①的离子方程式为 .
查看习题详情和答案>>

试回答下列问题:
(1)B的电子式为
(2)反应②的化学方程式为
(3)在常温下条件下,1mol F与J完全反应,放出a kJ的热量,则该反应的热化学方程式为
(4)已知C的沸点比G高,其原因是
(5)将过量P通入M的溶液中生成F,发生反应的离子方程式为
(6)反应①的离子方程式为
有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体.下列叙述中不正确的是( )
查看习题详情和答案>>
 铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS2+8O2
| ||
32
32
mol电子.(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为
2Fe3++Cu=2Fe2++Cu2+
2Fe3++Cu=2Fe2++Cu2+
;从腐蚀废液回收得到金属铜,还需要的试剂是铁粉、稀盐酸(稀硫酸)
铁粉、稀盐酸(稀硫酸)
.(3)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是
酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
.(4)钢铁的电化腐蚀简单示意图如图,将该图稍作修改 即可成为钢铁电化学防护的简单示意图,请在虚线框内作出修改,并用箭头标出电子流动方向

