摘要:烧杯中盛放0.1mol/L的H2SO4溶液.烧杯B中盛放0.1mol/L的CuCl2溶液.装置如右图所示.下列说法不正确的是 A.A为原电池.B为电解池 B.A为电解池.B为原电池 C.当A烧杯中产生0.1mol气体时.B烧杯中 产生的物质的量也为0.1mol D.经过一段时间.B烧杯中溶液的pH增大
网址:http://m.1010jiajiao.com/timu3_id_380160[举报]
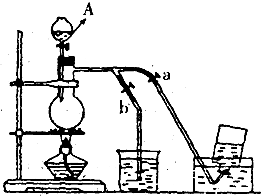 如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)
如图表示在没有通风橱的条件下制备氯气时设计的装置,图中a.b是可控制的弹簧铁夹.(氯气在饱和氯化钠溶液中的溶解度较小.)(1)仪器A的名称是
分液漏斗
分液漏斗
;水槽中应盛放的是饱和食盐水
饱和食盐水
;烧杯中盛放的是氢氧化钠溶液
氢氧化钠溶液
;烧瓶中反应的化学方程式MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
;
| ||
(2)在收集氯气时,应
关闭b,打开a
关闭b,打开a
.(填如何控制a.b)(3)若要制得标准状况下的Cl20.672L,理论上需要MnO2的质量是
2.61
2.61
g被氧化盐酸的物质的量0.06
0.06
mol(4)若要增大新制氯水中HClO的浓度可加入
C
C
A.食盐 B.水 C.CaCO3 D.NaOH.
硫酸铵是一种常用的铵态氮肥.下表是硫酸铵化肥品质的主要指标.?
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究 .?
.?
[观察外观]
该硫酸铵化肥无可见机械杂质.?
[实验探究]
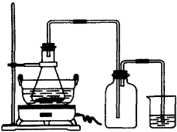
按如图所示装置进行实验.?
(1)烧瓶内发生反应的离子方程式为:
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g.得出探究结论为
查看习题详情和答案>>
| 指标 项目 |
优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
 .?
.?[观察外观]
该硫酸铵化肥无可见机械杂质.?
[实验探究]
按如图所示装置进行实验.?
(1)烧瓶内发生反应的离子方程式为:
NH4++OH-
NH3↑+H2O
| ||
NH4++OH-
NH3↑+H2O
烧杯中盛放的试剂最好是
| ||
稀硫酸
稀硫酸
(填“浓硫酸”、“稀硫酸”或“水”)(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
使硫酸铵充分反应完全转化为NH3
使硫酸铵充分反应完全转化为NH3
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
A、B装置间缺一个干燥装置
A、B装置间缺一个干燥装置
乙同学:实验装置中还存在另一个明显缺陷是:
缺少赶尽反应装置中残留氨气的装置
缺少赶尽反应装置中残留氨气的装置
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g.得出探究结论为
该化肥为合格品
该化肥为合格品
. 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀
 如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.
如图表示在没有通风橱的条件下制备氯气时的装置,图中a、b是可控制的弹簧铁夹.(已知:氯气在饱和氯化钠溶液中的溶解度较小.(1)仪器A的名称是
分液漏斗
分液漏斗
;烧杯中盛放的是
氢氧化钠溶液
氢氧化钠溶液
;烧瓶中发生的反应化学方程式为
MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
;
| ||
(2)在收集氯气时,应
关闭b,打开a
关闭b,打开a
.(填:如何操作a、b止水夹,下同),当氯气收集完毕时应关闭a,打开b
关闭a,打开b
.(3)若制得标准状况下的Cl2为0.672L,则被氧化的HCl的物质的量是
0.06mol
0.06mol
.