摘要:10.已知某400mL FeCl2溶液中含溶质0.25mol.向其中通入2.24L的Cl2.充分反应后溶液中的Fe3+的物质的量浓度为(假设反应前后溶液体积不变) ( ) A. 0.5mol/L B.0.625mol/L C.0.25mol/L D.0.125mol/L 11.两体积相同的密闭容器中均充入1 mol X和1mol Y.分别在300℃和500℃下发生如下反应:X.得到Z的 含量随时间t变化的a.b两条曲线. 已知在t3时刻改变了某一实验条件.相关判断正 确的是 ( ) A.曲线a是500℃时的图像 B.正反应是吸热反应 C.t3时刻可能是增大了压强 D.t3时刻可能是降低了温度
网址:http://m.1010jiajiao.com/timu3_id_379902[举报]
已知:A-F都是周期表中前四周期的元素,它们的原子序数依次增大.其中A、C原子的L层有2个未成对电子.D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构.F3+离子的M层3d轨道电子为半充满状态.请根据以上信息,回答下列问题:(答题时,用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为 .
(2)D元素的原子核外共有 种不同运动状态的电子、 种不同能级的电子.
(3)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因是 .AC2中心原子的杂化方式为 ,某离子与AC2互为等电子体,且能用于鉴别F3+,写出该离子的电子式 .
(4)写出E的电子排布式: .
(5)F和X(质子数为25)两元素的部分电离能数据列于表:
比较两元素的I2、I3可知,气态X2+再失去一个电子比气态F2+再失去一个电子难.对此,你的解释是 .
查看习题详情和答案>>
(1)A、B、C的电负性由小到大的顺序为
(2)D元素的原子核外共有
(3)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:
| 熔点 | 沸点 | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
(4)写出E的电子排布式:
(5)F和X(质子数为25)两元素的部分电离能数据列于表:
| 元素 | X | F | |
| 电离能kJ?mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
已知某有机物A的分子式是C2H4,能发生下列转化关系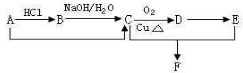 (部分反应物或生成物及反应条件已略去):下列说法正确的是( )
(部分反应物或生成物及反应条件已略去):下列说法正确的是( )
 (部分反应物或生成物及反应条件已略去):下列说法正确的是( )
(部分反应物或生成物及反应条件已略去):下列说法正确的是( )| A、该转化关系中有三个反应是取代反应 | B、B在浓硫酸加热的条件下能生成A | C、A、C、D都能使酸性高锰酸钾溶液褪色 | D、除F外F的同分异构体且属于F的同系物只有1种 |
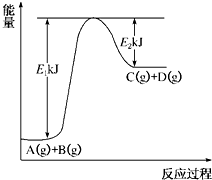 已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:
已知某反应A(g)+B(g)?C(g)+D(g)进行过程中的能量变化如图所示,请回答下列问题:(1)该反应的△H=
(2)若在反应体系中加入催化剂使逆反应速率增大,则E1
(3)在相同温度和压强下,对反应A(g)+B(g)?C(g)+D(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
| A | B | C | D | |
| 甲 | a mol | a mol | 0 | 0 |
| 乙 | 2a mol | a mol | 0 | 0 |
| 丙 | a mol | a mol | a mol | a mol |
| 丁 | a mol | 0 | a mol | a mol |
A.甲=丙>乙=丁 B.乙>丁>甲>丙 C.丁>乙>甲=丙 D.丙>乙=丁>甲
(4)若上述反应达到平衡,为了提高A的转化率,可以采用的措施有(写一条):
(5)在恒温恒容条件下进行上述反应.下列情况可以判断该反应达到平衡状态的是
A.气体平均摩尔质量不再变化 B.气体压强不再变化
C.气体密度不再变化 D.消耗A的速率等于消耗D的速率
E.各组分浓度之比为1:1:1:1 F.C生成的速率等于B消耗的速率.
(2012?百色二模)某有机物A可发生如图所示的变化:

已知E、F都能发生银镜反应,A、C都能使FeCl3溶液发生显色反应.请回答下列问题:
(1)C中含有的官能团名称是
(2)B能发生的反应类型是
①取代反应 ②加成反应 ③酯化反应 ④还原反应 ⑤消去反应
(3)A、C苯环上的一氯代物都只有一种,写出A可能的结构简式
 .1molA与NaOH溶液反应,最多能消耗NaOH
.1molA与NaOH溶液反应,最多能消耗NaOH
(4)反应⑤的化学方程式为
 (任写一个合理的).
(任写一个合理的).
(5)0.5mol E与足量的银氨溶液充分反应,生成的银单质用足量的硝酸溶解,生成的还原产物只有NO2和NO,标准状况下的体积为22.4L,则NO2和NO的体积比之为
查看习题详情和答案>>

已知E、F都能发生银镜反应,A、C都能使FeCl3溶液发生显色反应.请回答下列问题:
(1)C中含有的官能团名称是
羧基、羟基
羧基、羟基
.(2)B能发生的反应类型是
①③
①③
(填编号).①取代反应 ②加成反应 ③酯化反应 ④还原反应 ⑤消去反应
(3)A、C苯环上的一氯代物都只有一种,写出A可能的结构简式


5
5
mol.(4)反应⑤的化学方程式为


(5)0.5mol E与足量的银氨溶液充分反应,生成的银单质用足量的硝酸溶解,生成的还原产物只有NO2和NO,标准状况下的体积为22.4L,则NO2和NO的体积比之为
1:1
1:1
.(12分)Ⅰ、(1)现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵,则①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(2)已知某温度下,纯水中的C(H+)=5×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,将pH=11的NaOH溶液a L与pH=1的H2SO4的溶液b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a∶b= 。
Ⅱ、在一个容积固定的密闭容器中,要求通过调节体系的温度使反应A(g)+2B(g) 2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
2C( g)达到平衡时,保持容器内气体的总物质的量为12mol。现向反应容器中加入6.5molA,xmolB,2.0molC。
⑴若x=5.5时,需要降低体系温度使反应在平衡时达到题设条件,则正反应是 热反应。
⑵欲使反应维持向逆反应方向移动,则x的取值范围为 。
⑶在一定温度下的上述平衡体系中,另按1∶2的物质的量之比充入D、E两种气体(此时容器中的气体的总物质的量不要求保持12mol),按D(g)+E(g) 2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
2F(g)发生反应。当反应达到平衡时,D在这三种物质的混合体系中的体积分数为p%。若向容器中投入m molD,n molF和一定物质的量的E,在这三种物质的新的平衡体系中,D的体积分数仍为p%,则所投入E的物质的量为
(用m、n表示;设A、B、C和D、E、F之间均不发生反应)。
查看习题详情和答案>>