网址:http://m.1010jiajiao.com/timu3_id_379806[举报]
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 3 |
(1)常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:
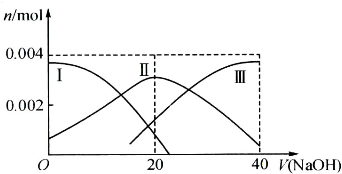
①当V(NaOH)=20mL时,溶液中离子浓度大小关系:
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ?mol-1;
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ?mol-1.
则Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=
工业上制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=
步骤一:电解精制:

请回答以下问题:
电解时,粗铜应与电源的
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式:
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au+6HNO3(浓)═Au(NO3)3+3NO2↑+3H2O | <<1 |
| 2 | Au3++4Cl-═AuCl4- | >>1 |
(2)滤液含量的测定:
以下是该小组探究滤液的一个实验流程:

则100mL滤液中Cu2+ 的浓度为
(22分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A,根据碘水用量可计算SO2的量,与气体流量计数据之比即可判断SO2是否超标。

(1)已知二氧化硫与碘水的反应为: SO2+ I2+ H2O== H2SO4+ HI,配平该反应并指出还原剂 。
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是: 。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量
(填“偏高”、“偏低”或“无影响”)。
乙方案:尾气被过氧化氢氧化后与氢氧化钡反应,实验步骤如以下流程图所示:

(4)写出步骤①中反应的化学方程式 。
(5)写出步骤②中反应的化学方程式 。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为 (用含有V、m的代数式表示)。
(7)若将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同,你认为这样处理是否合理 ,说明理由: 。
查看习题详情和答案>>
(1)100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为______
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积(Ksp).如Cu(OH)2?Cu2++2OH-
Ksp=c(Cu2+)?c2(OH-)=2×10-20.溶液里各离子浓度(包括其方次)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解.
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于______.
②要使0.2mol/L CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+溶液降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液pH为______.
(3)25℃在等体积的①pH=0的H2SO4溶液,②0.05mol?L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是______
(4)在100℃时,向V mL pH=a的盐酸中滴加pH=b的NaOH溶液10V mL,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)的值为______.
(1)100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得混合溶液pH=7,则NaOH溶液与硫酸溶液的体积比为
(2)难溶电解质在水溶液中存在着电离平衡.在常温下,溶液中各离子浓度以它们的系数为次方的乘积是一个常数,这个常数叫溶度积(Ksp).如Cu(OH)2?Cu2++2OH-
Ksp=c(Cu2+)?c2(OH-)=2×10-20.溶液里各离子浓度(包括其方次)的乘积大于溶度积时则出现沉淀;反之则沉淀溶解.
①某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,应调整溶液的pH,使之大于 .
②要使0.2mol/L CuSO4溶液中的Cu2+沉淀较为完全(使Cu2+溶液降低至原来的千分之一),则应向溶液中加入NaOH溶液,使溶液pH为 .
(3)25℃在等体积的①pH=0的H2SO4溶液,②0.05mol?L-1的Ba(OH)2溶液,③pH=10的Na2S溶液,④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
(4)在100℃时,向V mL pH=a的盐酸中滴加pH=b的NaOH溶液10V mL,所得混合溶液中c(Cl-)=c(Na+),则此时(a+b)的值为 . 查看习题详情和答案>>