网址:http://m.1010jiajiao.com/timu3_id_379734[举报]
(8分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验 编号 | HA物质的量 浓度(mol· L-1) | NaOH物质的 量浓度(mol· L-1) | 混合溶液的 pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其他组的实验结果,单从甲组情况分析,
若a________7(填“>”、“<”或“=”),则HA为强酸;
若a________7(填“>”、“<”或“=”),则HA为弱酸。
(2)在乙组中混合溶液中离子浓度c(A-)与c(Na+)的大小关系是( )
| A.前者大 | B.后者大 |
| C.二者相等 | D.无法判断 |
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=________mol·L-1。 查看习题详情和答案>>
(14分) 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度(mol/L) | 混合后溶液的pH |
| 甲 | 0.2 | 0.2 | pH = a |
| 乙 | C1 | 0.2 | pH = 7 |
| 丙 | 0.2 | 0.1 | pH >8 |
| 丁 | 0.1 | 0.1 | pH = 9 |
(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a来说明HA是强酸还是弱酸。
__________________________________________
 _____________________________________。
_____________________________________。(2)不考虑其他组的实验结果,单从乙组情况分析,C1是否一定等于0.2 mol/L________ ,混合后溶液中离子浓度c(A-)和c(Na+)的大小关系是c(A-)_______ c(Na+) (填>、<、=)。
(3)从丙组实验结果分析,HA是_______酸(强、弱),该混合液中的离子浓度由大到小的顺序是______________________________________
(4)丁组混合液中,由水电离的c(H+) = mol·L-1,c (Na+)-c (A-)= mol·L-1;
(5)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7 (填>、<、= );
(6)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
按c(NH4+)由大到小的顺序排列 (填序号) 查看习题详情和答案>>
(6分)常温下,某水溶液M中存在的离子有:Na+、A一、H+、OH一。根据题意回答下列问题:
(1)若溶液M由0.1mo1/L的HA溶液与0.1mol/L的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”).
(2)若溶液M的pH>7,则c(Na+) c(A一)(填“>”、“<”或“=”).
(3)常温下,若溶液M由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2mL混合反应而得,则下列说法中正确的是 (填字母).
A.若溶液M呈中性,则溶液M中c(H+)+c(OH一)=2×10-7mol/L
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
查看习题详情和答案>>
| |||||||||||||||||||||||||

己知熔点:乙酸16.6℃、苯酚43℃.沸点:乙酸118℃、苯酚182℃.
(1)写出②的反应化学方程式
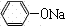 +CO2+H2O→
+CO2+H2O→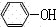 +NaHCO3;
+NaHCO3;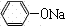 +CO2+H2O→
+CO2+H2O→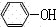 +NaHCO3;
+NaHCO3;(2)②中分离B的操作名称是
(3)现对物质C的性质进行实验探究,请你帮助实验小组按要求完成实验过程记录,在答题卡上填写出实验操作、预期现象和现象解释.
| 实验操作 | 预期现象 | 现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,震荡. | 出现白色浑浊 出现白色浑浊 |
苯酚常温下溶解度不大 苯酚常温下溶解度不大 |
| 步骤2:取少量C的稀溶液分装b、c两只试管,往b试管 滴入过量饱和溴水,振荡. 滴入过量饱和溴水,振荡. |
产生白色沉淀 | 苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. 苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. |
| 步骤3:往c试管 滴入几滴FeCl3溶液,振荡 滴入几滴FeCl3溶液,振荡 |
溶液变为紫色 溶液变为紫色 |
C与加入的试剂发生显色反应. |
(4)称取一定量的C试样,用水溶解后全部转移至1000mL容量瓶中定容.取此溶液.25.OOmL,加入KBr03浓度为0.01667moL?L-1,的KBr03+ KBr标准溶液30.OOmL,酸化并放置.待反应完全后,加入过量的KI,再用0.1100moL-L-1,Na2S203标准溶液滴成的12,耗去Na2S203标准溶液11.80mL o则试样中C物质的量的计算表达式为:
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
| 1 |
| 3 |
| 1 |
| 2 |
| 1000mL |
| 25.00mL |
(部分反应离子方程式:)BrO
- 3 |
2- 3 |
2- 6 |