网址:http://m.1010jiajiao.com/timu3_id_379715[举报]
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g 的氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是______________,其相应的质量为________。
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热ΔH=________。
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式:________________。
命题意图:本题以磷为载体,考查燃烧热、盖斯定律及热化学方程式的有关知识,重点是考查燃烧热定义和盖斯定律的理解和应用,而涉及磷的知识并不复杂。
查看习题详情和答案>>
试回答:
(1)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接
(2)D、E两支试管中CCl4的作用是
(3)本实验能证明浓硫酸具有强氧化性的实验现象为
(4)D中出现浑浊的离子方程式为
(5)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加.请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因是
二班小组设计了下图装置:

(6)分析出二班小组的设计意图是
(7)装置B中的药品是
(8)能证明产生SO2和H2先后顺序的实验现象是
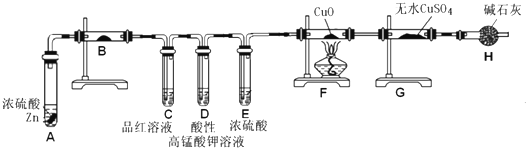
某校两个化学研究性学习小组,在学习了铜和浓硫酸的反应后分别探究足量的锌与浓硫酸反应的过程。甲小组设计了下图装置:试回答:
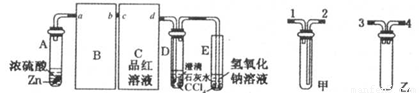
(1)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接______, c接______ (用序号表示)。
(2)D、E两支试管中CCl4的作用是______。
(3)本实验能证明浓硫酸具有强氧化性的实验现象为______。
(4)D中出现浑浊的离子方程式为______。
(5)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加。请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因是______。
乙小组设计了下图装置:
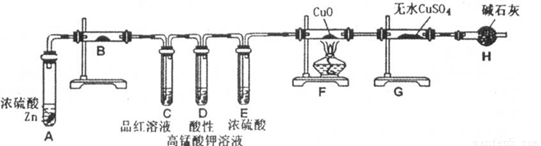
(6)分析出乙小组的设计意图是______。
(7)装置B中的药品是______。
(8)能证明产生SO2和H2先后顺序的实验现象是______。
查看习题详情和答案>>
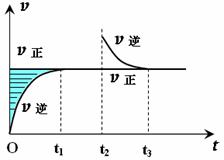 某恒温密闭容器发生可逆反应Z(?)+W(?)
某恒温密闭容器发生可逆反应Z(?)+W(?)![]() X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是 ( )
A.Z和W在该条件下一定不为气态
B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均
摩尔质量不可能相等
(※是命题者原创题,难度较大,本选项由于命题者未考 虑周全作了修改,否则无答案。)
C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2
时间段与t3时刻后的X浓度相等
D.若该反应只在某温度T0以上自发进行,则该反应的平衡常数K随温度升高而增大
查看习题详情和答案>>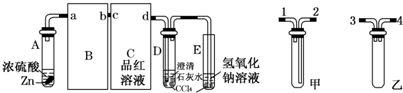
试回答:
(1)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____________接d(用序号表示).
(2)D、E两支试管中CCl4的作用是______.
(3)本实验能证明浓硫酸具有强氧化性的实验现象为______.
(4)D中出现浑浊的离子方程式为______.
(5)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加.请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因是______.
二班小组设计了下图装置:
(6)分析出二班小组的设计意图是______.
(7)装置B中的药品是______.
(8)能证明产生SO2和H2先后顺序的实验现象是______.