摘要:010 mol·L-1+2x)2·x =1.1×10-12 x的值很小. 0.010 mol·L-1+2x ≈0.010 mol·L-1 x=1.1×10-8 mol·L-1 即c(Ag2CrO4)=1.1×10-8 mol·L-1 [使用与讲评建议] 本题可以作为化学计算或化学平衡专题复习的例题或习题.讲评时注意:⑴比较难溶电解质的溶解平衡与弱电解质的电离平衡的区别,⑵归纳“勒沙特列原理 的适用范围.适用于所有的动态平衡.如化学平衡.电离平衡.水解平衡.电离平衡等,⑶引领学生分析体会物质的溶解性与溶解度和溶度积之间的关系,⑷举例让学生感悟复分解反应类型的离子反应的本质.
网址:http://m.1010jiajiao.com/timu3_id_379712[举报]
反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g),在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率V(x)可表示为( )
查看习题详情和答案>>
 (2012?长宁区二模)铁是一种重要的金属,它的单质及化合物有着各自的性质.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图所示:
(2012?长宁区二模)铁是一种重要的金属,它的单质及化合物有着各自的性质.一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)?FeO(s)+CO(g),已知该反应的平衡常数(K)与温度(T)的关系如图所示:(1)如果该反应的平衡常数K值变大,该反应
bc
bc
(选填编号).a.一定向逆反应方向移动 b.在平衡移动时正反应速率先增大后减小
c.一定向正反应方向移动 d.在平衡移动时逆反应速率先减小后增大
(2)如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,(选填编号)
abc
abc
.a.容器中气体的平均分子量不随时间而变化 b. v(CO)=v(CO2)
c.容器中气体的密度不随时间而变化 d.通入稀有气体能提高反应的速率
(3)请用上述反应中某种气体的有关物理量来说明该反应处于不平衡状态:
①
CO或(CO2)的生成速率与消耗速率不相等
CO或(CO2)的生成速率与消耗速率不相等
②CO(或CO2)的质量改变
CO(或CO2)的质量改变
(4)若反应的容器容积不变且为2.0L,反应时间5.0min,容器内气体的密度减小了0.80g/L,在这段时间内CO2的平均反应速率为
0.010 mol?L-1?min-1
0.010 mol?L-1?min-1
.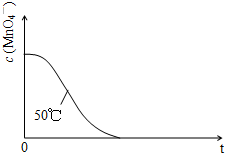 (2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.
(2013?广州模拟)某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.该小组设计了如下的方案.| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol?L-1 | 体积/mL | 浓度/mol?L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
2
2
mol 电子.为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:c(H2C2O4):c(KMnO4)≥2.5
2.5
.(2)探究温度对化学反应速率影响的实验编号是
②和③
②和③
(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是①和②
①和②
.(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=
0.010
0.010
mol?L-1?min-1.(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图.若保持其他条件不变,请在答题卡坐标图中,画出25℃时c(MnO4-)~t的变化曲线示意图.