摘要:5. [命题意图] 该题考查实验基本操作和实验方案分析与设计能力. [参考答案] (1)A D C B 引流 使液体受热均匀.防止液体飞溅 将不溶固体表面吸附的钾盐全部转入滤液中.减少误差 硫酸 (2) ①关闭酸式滴定管.用手捂热烧瓶.若注射器活塞外移.说明气密性良好,或关闭滴定管活塞.记下注射器刻度.然后轻轻推(拉)动活塞.松手后.注射器活塞回到原位.证明不漏气,或从酸式滴定管向烧瓶中加入一定量的水.注射器增大的体积与加入水的体积相等.证明不漏气. 6911200m ②从分液漏斗中加入液体引起测量气体体积增大 CO2溶于水引起测量气体体积减小 样品 ③如右图( 贮水瓶中也可以放水并在水面上加一层植物油) 饱和NaHCO3溶液 ④反应前装有药品的整个装置的质量 反应后整个装置的质量 因反应后残留的CO2替换了原有的空气.引起少许误差.试管体积小.误差更小. [使用与讲评建议] 本题可作为化学实验方案设计专题复习例题或练习.教师启发.点拨.学生合作互动.将讲评课演化为研究课.训练学生严谨思维能力和实验分析设计能力.
网址:http://m.1010jiajiao.com/timu3_id_379696[举报]
磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g 的氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是______________,其相应的质量为________。
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热ΔH=________。
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式:________________。
命题意图:本题以磷为载体,考查燃烧热、盖斯定律及热化学方程式的有关知识,重点是考查燃烧热定义和盖斯定律的理解和应用,而涉及磷的知识并不复杂。
查看习题详情和答案>> (2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气
(2010?烟台一模)硫酸工厂周围的空气中有较多的二氧化硫.某研究性学习小组为了测定空气中二氧化硫的体积分数设计了如下两个方案:
方案一:取标准状态下的空气V L(内含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得的溶液中加入过量的氯化钡溶液后,过滤,将沉淀洗涤、干燥,称得其质量为m g.
请回答:
(1)加入过量的氯化钡溶液的目的是
使生成的SO42-完全转化为沉淀
使生成的SO42-完全转化为沉淀
.(2)过滤后,若在滤液中加入硫酸钠溶液,有白色沉淀产生,说明
所加入的BaCl2溶液过量,SO42-已完全转化为沉淀
所加入的BaCl2溶液过量,SO42-已完全转化为沉淀
.(3)过滤后,一般要用蒸馏水洗涤沉淀2-3次,以除去附在沉淀上的可溶性物质.请说明应通过什么方法验证可溶物质是否已被除尽(要求:实验过程、使用的试剂、现象及结论)
方案二:如图所示,装置中反应管内装有碘的淀粉溶液.按设计意图,将空气(内含N2、O2、CO2、SO2等)通过此装置时,其中的SO2被吸收,量气管内增加的体积为其余气体的体积.
(4)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2的含量
偏低
偏低
(选填“偏高”、“偏低”或“不受影响”).(5)反应管内碘的淀粉溶液可以用下列
B
B
(填代号)代替.A.NaOH溶液 B.酸性KMnO4溶液
C.Na2SO3溶液 D.BaCl2溶液
(6)研究小组经过讨论发现方案二的设计中有一个明显的缺陷影响了测定结果(不属于操作错误),你认为该缺陷是
溶液中在I2将SO2氧化的同时,原空气中的O2也能将SO2氧化而被吸收,导致所测含量偏高
溶液中在I2将SO2氧化的同时,原空气中的O2也能将SO2氧化而被吸收,导致所测含量偏高
.已知A、B、C、D、E都是短周期的元素,它们的原子序数依次递增.A原子的原子序数、电子层数与它的最外电子数相同,而B原子的最外层电子数是次外层的2倍,D与A同主族,且与E同周期,E元素的原子半径是同周期元素中最小的,A、B、D这三种元素中,每一种都与C元素形成原子个数比不相同的化合物.则:
(1)E元素的原子结构示意图 .
(2)B和C两元素相比较,非金属性较强的是 (填元素名称),可以验证该命题结论的是 (填写编号);
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)由B和C组成,且B和C的质量比为3:8的化合物的电子式是 .
(4)E单质与D的最高价氧化物的水化物反应的离子方程式为 .
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式 .
查看习题详情和答案>>
(1)E元素的原子结构示意图
(2)B和C两元素相比较,非金属性较强的是
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的单质在常温下的状态
C.比较这两种元素气态氢化物的稳定性
D.比较这两种元素单质与氢气化合的难易
(3)由B和C组成,且B和C的质量比为3:8的化合物的电子式是
(4)E单质与D的最高价氧化物的水化物反应的离子方程式为
(5)将8g BA4完全燃烧后恢复到室温,放出热量a kJ,写出表示BA4的燃烧热的热化学方程式
 某同学欲用Cu与浓H2SO4反应制备SO2,并通过一定装置除去制得的SO2中存在的少量水蒸气和O2,以此来探究SO2能使品红褪色的具体情况以及能否对发黄的小麦秸秆进行漂白,设计装置如图所示,请完成下列问题.
某同学欲用Cu与浓H2SO4反应制备SO2,并通过一定装置除去制得的SO2中存在的少量水蒸气和O2,以此来探究SO2能使品红褪色的具体情况以及能否对发黄的小麦秸秆进行漂白,设计装置如图所示,请完成下列问题.(1)A部分装置发生化学反应的原理为:
(2)C部分的燃烧管中放有
(3)D瓶中装的是小麦秸秆,根据实验设计意图,应观察小麦秸秆可能出现的
(4)取出少量褪色的品红溶液于试管中,加热片刻,试管中的溶液变为
(5)有同学认为该装置仍存在缺陷,原因是
某学生利用以下装置探究纯净干燥的氯气与氨气之间的反应.
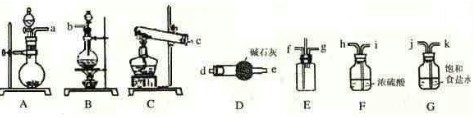
回答下列问题:
(1)根据下列所给试剂,选择制取氨气的装置是(填对应字母)
二氧化锰、碱石灰、浓盐酸、浓氨水、烧碱、生石灰
(2)已知,E装置是用于使纯净干燥的氯气与氨气发生反应的装置,试说明该装置的设计意图:
(3)根据实验目的,所选装置的连接顺序为(填装置的接口字母):
(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,该反应的化学方程式为:
(5)请你评价此套装置有何缺点
查看习题详情和答案>>

回答下列问题:
(1)根据下列所给试剂,选择制取氨气的装置是(填对应字母)
A
A
;写出制备氯气的离子反应方程式MnO2+4H++2C1-
Mn2++C12↑+2H2O
| ||
MnO2+4H++2C1-
Mn2++C12↑+2H2O
.
| ||
二氧化锰、碱石灰、浓盐酸、浓氨水、烧碱、生石灰
(2)已知,E装置是用于使纯净干燥的氯气与氨气发生反应的装置,试说明该装置的设计意图:
将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力
将比空气轻的氨气从长管口f进入,比空气重的氯气从短管口g进入,使反应气体逆流接触充分反应,中间导管用于排出空气以减少内部压力
.(3)根据实验目的,所选装置的连接顺序为(填装置的接口字母):
a
a
接d
d
,e
e
接( f ),( g )接h
h
,i
i
接j
j
,k
k
接b
b
;其中,G装置的作用是除去C12中的HCl气体
除去C12中的HCl气体
.(4)氯气和氨气在常温下相混合就会发生反应生成氯化铵和氮气,该反应的化学方程式为:
3C12+8NH3=6NH4Cl+N2
3C12+8NH3=6NH4Cl+N2
;其中,氧化剂与还原剂的物质的量之比是3:2
3:2
.(5)请你评价此套装置有何缺点
缺少尾气处理装置,造成空气污染
缺少尾气处理装置,造成空气污染
.