网址:http://m.1010jiajiao.com/timu3_id_379329[举报]
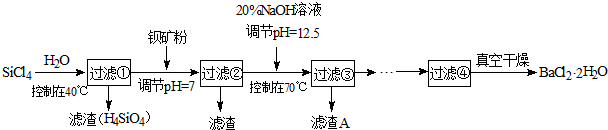
已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
②M (BaCO3)=197g/mol,M(BaCl2?2H2O)=244g/mol
(1)SiCl4水解反应的方程式为
SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
(2)加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2和
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(4)BaCl2滤液经
(5)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2?2H2O
②M (BaCO3)=197g/mol,M(BaCl2?2H2O)=244g/mol
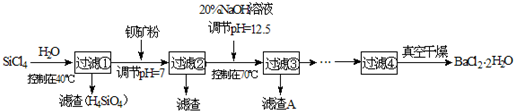
(1)SiCl4水解反应的方程式为
(2)已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol则由SiCl4制备硅的热化学方程式为
(3)加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2和
(4)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(5)BaCl2滤液经
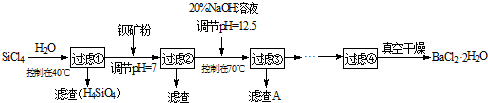
(1)SiCl4水解控制在40℃以下的原因是
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g)△H1=+47kJ/mol;SiHCl3(s)+H2(g)=Si(s)+3HCl(g)△H2=+189kJ/mol
则由SiCl4制备硅的热化学方程式为
(2)加钡矿粉时生成BaCl2的离子反应方程式是
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到?2H2O.实验室中蒸发浓缩用到的含硅酸盐的仪器有
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是
(12分)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)SiCl4水解控制在40℃以下的原因是 ▲ 。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则由SiCl4制备硅的热化学方程式为 ▲ 。
(2)加钡矿粉时生成BaCl2的离子反应方程式是 ▲ 。
(3)加20%NaOH调节pH=12.5,得到滤渣A的主要成分是 ▲ ,控制温度70℃的目的是 ▲ 。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。实验室中蒸发浓缩用到的含硅酸盐的仪器有 ▲ 种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是 ▲ 。
查看习题详情和答案>>
(12分)多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有钙、铁、镁等离子)制备BaCl2·2H2O,工艺流程如下。已知常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
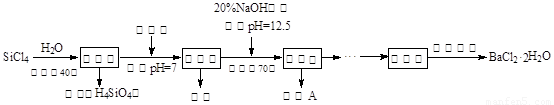
(1)SiCl4水解控制在40℃以下的原因是 ▲ 。
已知:SiCl4(s)+H2(g)=SiHCl3(s)+HCl(g) ΔH1=47 kJ/mol
SiHCl3(s)+H2(g)=Si(s)+3HCl(g) ΔH2=189 kJ/mol
则由SiCl4制备硅的热化学方程式为 ▲ 。
(2)加钡矿粉时生成BaCl2的离子反应方程式是 ▲ 。
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是 ▲ ,控制温度70℃的目的是 ▲ 。
(4)BaCl2滤液经蒸发浓缩、降温结晶、过滤,再经真空干燥后得到·2H2O。实验室中蒸发浓缩用到的含硅酸盐的仪器有 ▲ 种。
(5)为体现该工艺的绿色化学思想,该工艺中能循环利用的物质是 ▲ 。
查看习题详情和答案>>