网址:http://m.1010jiajiao.com/timu3_id_379280[举报]
(8分) 铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的,位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中其中+3较为稳定。我校化学兴趣小组对铬的化合物进行探究性研究。
Ⅰ、查阅资料
(1)Cr2O3微溶于水,与Al2O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物。
(2)工业上和实验室中常见的铬(+6价)化合物是其含氧酸盐,如铬酸盐和重铬酸盐,以K2Cr2O7和Na2Cr2O7最为重要。工业废水中含有Cr3+,可以通过加入石灰,降低溶液的酸度,当PH为8~9时,Cr3+能形成沉淀而分离。
Ⅱ、工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量的NaCl,以Fe为电极进行电解,经过一段时间有Cr(OH)3和Fe(OH)3沉淀生成,使废水中的铬含量达排放标准。
①在装置中应该用 (填材料名称)做电解池的阳极。能否用石墨做电极,说明原因______________________________________________________________,
阴极上电极反应方程式是 。
②Cr2O72- 在酸性条件下有强氧化性,试写出Cr2O72-转变成Cr3+的离子方程式。
。
查看习题详情和答案>>(1)现用物质的量浓度为amol/L的标准盐酸去测定VmLNaOH溶液的物质的量浓度,请填写下列空白:
①酸式滴定管用蒸馏水洗净后,还应该进行的操作是_______________________。
②下图是酸式滴定管中液面在滴定前后的读数,则被测NaOH溶液的的物质的量浓度为:c(NaOH)= ________________。
③若在滴定前滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失,则测得的NaOH溶液的物质的量浓度会偏_________________。
(2)平衡常数表明了封闭体系的可逆反应在给定的温度下进行的程度,对于同一个类型的反应,平衡常数越大,表明反应进行的程度越大。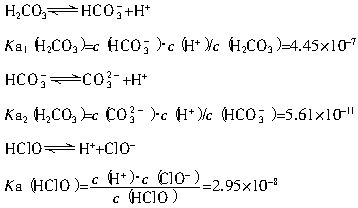
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
①将过量的氯气通入到少量的碳酸钠溶液中______________________________________;
②氯气和碳酸钠按照1∶1的比例恰好反应_____________________________________。
(3)铬是1979年法国化学家沃克兰在分析铬铅矿时首先发现的。铬位于周期表中第四周期ⅥB族,其主要化合价为+6、+3、+2,其中+3较为稳定。某兴趣小组对铬的化合物进行探究性研究发现:Cr2O3微溶于水,与A12O3类似,是两性氧化物;Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡。Cr(OH)3酸式电离的电离方程式是:_________。