摘要:2.Na2CO3溶液中滴加盐酸过程不清楚. 在Na2CO3溶液中滴加HCl.CO32-先转化为HCO3-.再滴加盐酸HCO3-转化为H2CO3.不稳定分解为CO2. 如:在10mL0.01mol/L纯碱溶液中.不断搅拌并逐滴加入1.2mL0.05mol/L盐酸.完全反应后在标准状况下生成二氧化碳的体积为 A.1.334mL B.2.240mL C.0.672mL D.0mL 思路分析:反应过程为:CO32-HCO3-CO2. 盐酸溶液中n(HCl)=0.00006mol.纯碱溶液中n(Na2CO3)=0.0001mol CO32- + H+ = HCO3-
网址:http://m.1010jiajiao.com/timu3_id_379228[举报]
碳酸钠和碳酸氢钠是重要的工业原料.某学生活动小组为探究它们的性质并测定某天然碱的成分进行了下述实验.
Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)
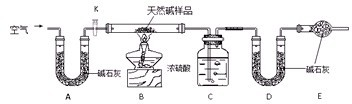
Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数).现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g.实验时忽略装置内空气中的CO2和水蒸气.
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明
(2)NaHCO3受热分解的化学方程式为
(3)E处碱石灰的作用
(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是
查看习题详情和答案>>

Ⅰ.向Na2CO3溶液中滴入酚酞试液后溶液显红色,原因是(写离子方程式)
CO32-+H2O?HCO3-+OH-
CO32-+H2O?HCO3-+OH-
;向上述溶液中滴入过量CaCl2溶液,观察到的现象是产生白色沉淀,且溶液红色褪去
产生白色沉淀,且溶液红色褪去
.Ⅱ.某天然碱的组成为aNa2CO3?bNaHCO3?cH2O(a、b、c为正整数).现用下图所示装置(夹持仪器已略去)确定其组成,其中天然碱样品质量为7.3g.实验时忽略装置内空气中的CO2和水蒸气.
请回答:
(1)在用托盘天平称量样品时,如果天平指针向左偏转,说明
样品重于砝码
样品重于砝码
;(2)NaHCO3受热分解的化学方程式为
2NaHCO3
Na2CO3+H2O+CO2↑
| ||
2NaHCO3
Na2CO3+H2O+CO2↑
;
| ||
(3)E处碱石灰的作用
防止空气中的CO2和水蒸气进入U型管D中
防止空气中的CO2和水蒸气进入U型管D中
;(4)反应停止后打开活塞K,缓缓鼓入空气数分钟,该步骤的目的是
使反应产生的CO2和水蒸气被充分吸收
使反应产生的CO2和水蒸气被充分吸收
.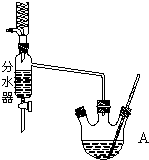 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题:(1)揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯.请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式
CH3COOH+H18OCH2CH3
CH3CO18OCH2CH3+H2O
| 浓硫酸 |
| △ |
CH3COOH+H18OCH2CH3
CH3CO18OCH2CH3+H2O
.| 浓硫酸 |
| △ |
②能否用氢同位素示踪法揭示酯化反应原理?
不能
不能
(选填“能”或“不能”),原因是醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基
醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基
.(2)反应温度确定:
合成乙酸乙酯的反应为放热反应.实验表明,反应温度应控制在85℃左右为宜.回答:
实验温度不宜低于85℃左右的原因是
反应速率低,达不到催化剂活性温度
反应速率低,达不到催化剂活性温度
;实验温度不宜高于85℃左右的原因是
温度过高利于平衡逆向移动,酯产率降低
温度过高利于平衡逆向移动,酯产率降低
;(3)实验装置的比较:
利用图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是
用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率
用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率
.(4)酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴
酚酞
酚酞
试液,现象是碳酸钠层呈红色,上层的酯层呈无色
碳酸钠层呈红色,上层的酯层呈无色
.