摘要:23.已知X是一种碱式盐.H是常见金属单质.F.I是常 见非金属单质.E.G都是工业上重要的碱性物质.它们有右 图所示的关系. 试回答下列问题: (1)G的化学式为: . (2)写出下列反应的化学方程式 ① . ② . (3)X在医药上用作解酸剂.与盐酸作用时.生成B的物质 的量与消耗盐酸的物质的量之比为3:8.则X的化学 式为: .
网址:http://m.1010jiajiao.com/timu3_id_378964[举报]
已知X是一种碱式盐,H是常见金属单质,F、I是常见非金属单质,E、C都是工业上重要的碱性物质,它们有下图所示的关系。
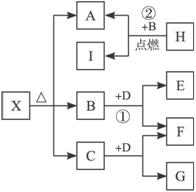
试回答下列问题:
(1)G的化学式为_________________。
(2)写出下列反应的化学方程式
①____________________________________________________;
②____________________________________________________。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质的量与消耗盐酸的物质的量之比为3∶8,则X的化学式为____________________。
查看习题详情和答案>>已知X是一种碱式盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有右
图所示的关系。
试回答下列问题:
(1)G的化学式为: 。
(2)写出下列反应的化学方程式
① ,
② 。
(3)X在医药上用作解酸剂,与盐酸作用时,生成B的物质
的量与消耗盐酸的物质的量之比为3:8,则X的化学
式为: 。
查看习题详情和答案>>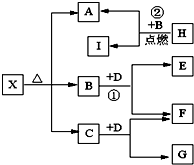 已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.
已知X是一种酸式盐,H是常见金属单质,F、I是常见非金属单质,D为淡黄色固体,E、G都是工业上重要的碱性物质,A物质可做耐火材料.它们有如图所示的转化关系.试回答下列问题
(1)X的化学式为:
Mg(HCO3)2
Mg(HCO3)2
;G的电子式为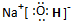
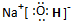
(2)写出下列反应的化学方程式
①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
②2Na2O2+2H2O═4NaOH+O2↑
2Na2O2+2H2O═4NaOH+O2↑
.(3)H与同周期原子序数比其大一的另一种金属组成原电池,H作正极,则负极反应式为
Al+4OH--3e-=AlO2-+2H2O
Al+4OH--3e-=AlO2-+2H2O
,电解质溶液为NaOH溶液
NaOH溶液
.(4)H的工业制法可用电解原理,当阳极产生可使湿润的淀粉KI试纸变蓝的气体1.12升(标况)时,阴极生成H
1.2
1.2
克,有关化学方程式为MgCl2(熔融)
Mg+Cl2↑
| ||
MgCl2(熔融)
Mg+Cl2↑
.
| ||
