摘要:13.向100mLFeCl2溶液中滴人含Br2 0.05mo1的溴水.测得加入的溴已完全反应.形成的溶液不含Fe2+.则原FeCl2溶液的物质的量浓度为 A.0.5mol/L B.1mol/L C.1.5m01/L D.2m01/1.
网址:http://m.1010jiajiao.com/timu3_id_378883[举报]
 在一烧杯中盛有稀硫酸,有一塑料小球(与酸、碱均不发生反应)悬浮于溶液中,如图所示.
在一烧杯中盛有稀硫酸,有一塑料小球(与酸、碱均不发生反应)悬浮于溶液中,如图所示.(1)向烧杯中慢慢加入与稀硫酸密度相同(均大于1g?cm-3)的Ba(OH)2溶液至恰好反应完全,在实验中可观察到的现象有:
①
产生白色沉淀
产生白色沉淀
;②
小球下沉至烧杯底部
小球下沉至烧杯底部
.烧杯中所发生反应的离子方程式为
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
.(2)若向烧杯中加入的不是Ba(OH)2溶液,而是锌粒,在实验中可观察到的现象有:
①
有气泡冒出
有气泡冒出
;②
小球上浮
小球上浮
.烧杯中发生反应的离子方程式为
Zn+2H+=Zn2++H2↑
Zn+2H+=Zn2++H2↑
.浅绿色的硫酸亚铁铵晶体[又名莫尔盐(NH4)2SO4?FeSO4?6H2O]比绿矾(FeSO4?7H2O)更稳定,常用于定量分析.莫尔盐的一种实验室制法如下:
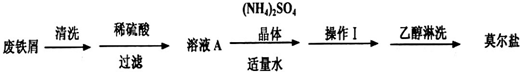
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
证明溶液A不含Fe3+离子的最佳试剂是
a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接

将装置C中两种液体分离开的操作名称是
查看习题详情和答案>>

(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
防止Fe2+离子被氧化为Fe3+离子
防止Fe2+离子被氧化为Fe3+离子
;证明溶液A不含Fe3+离子的最佳试剂是
b
b
(填序号字母).a.酚酞溶液 b.KSCN溶液 c.烧碱溶液 d.KMnO4溶液
操作I的步骤是:加热蒸发、
冷却结晶
冷却结晶
、过滤.(2)浓度均为0.1mol?L-1莫尔盐溶液和(NH4)2SO4溶液,c(NH4+)前者大于后者,原因是
莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者
莫尔盐中的Fe2+离子易水解,趋使溶液显酸性,抑制NH4+水解,故c(NH4+)前者大于后者
.(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平
左
左
(填“左”“右”)盘.(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接
d
d
;e
e
接f
f
.
将装置C中两种液体分离开的操作名称是
分液
分液
.装置D的作用是吸收多余的NH3防止污染空气,防止倒吸
吸收多余的NH3防止污染空气,防止倒吸
.