网址:http://m.1010jiajiao.com/timu3_id_378863[举报]
(15分)某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因
_______________________________________________________________________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1mol·L-1 KSCN溶液;0.1 mol·L-1 KI溶液;0.2 mol·L-1酸性高锰酸钾溶液;氯水等;试管和滴管
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 | | |
| 第二步 | | 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+。 | |

(3)装置乙的作用: 。
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定
气体Y中含NO?说明理由。
________________________________________________________________________。
(5) 同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15 mol·L-1酸性KMnO4溶液滴定,消耗20 mLKMnO4溶液。
则气体Y中NO、NO2的体积比为 。
(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O) 查看习题详情和答案>>
(15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知: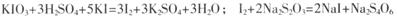
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数="______" ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
(15分) 某校化学兴趣小组为了探究粗铁粒(含有少量金属铜杂质)与某浓度硝酸反应,设计了如下探究活动:
探究一
(1)将粗铁粒投入某浓度硝酸中,某同学观察该实验现象时发现,反应进行一段时间后,反应开始逐渐加快。请分析反应逐渐加快的可能原因
_______________________________________________________________________。
(2)另称取粗铁粒10 g放入某浓度硝酸中,充分反应后得到溶液X并收集到气体Y。为了探究溶液X中铁元素的价态,同学甲设计如下实验:有药品和仪器:0.1
请你设计简单实验,探究上述猜想是否正确,填写下列实验报告:
| 实验步骤 | 现象 | 结论 | 离子方程式 |
| 第一步 | 取2-3 mL溶液装于试管,向试管中加入几滴KSCN溶液。 |
|
|
| 第二步 |
| 若溶液紫色褪去,则溶液含有Fe2+; 若无明显变化,则不含Fe3+。 |
|
探究二 为了探究气体Y的成分,同学乙设计了如下装置(不考虑NO2转化为N2O4)
(3)装置乙的作用: 。
(4)装置丙收集到满气体后,通过气泡鼓入空气后,有红棕色气体生成,能否确定
气体Y中含NO? 说明理由。
________________________________________________________________________。
(5) 同学丁为了探究气体Y的组成,将224mL气体Y通入足量的NaOH溶液中,气体被完全吸收,所得溶液再用0.15 mol·L-1酸性KMnO4溶液滴定,消耗20 mLKMnO4溶液。
则气体Y中NO、NO2的体积比为 。
(已知2NO2+2NaOH=NaNO3+NaNO2+H2O和NO2+NO+2NaOH=2NaNO2+H2O)
查看习题详情和答案>>
(15分)某化学小组为测定加碘盐中KIO3的质是分数并制备少量KIO3,进行了如下实验。
I .测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:
步骤一:准确称取a g加碘盐,配制成250 mL溶液;
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c mol.L-1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据。重复滴定2次,平均消耗Na2S2Or溶液12.00 mL。
(1) 步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有____________
(2) 步骤三中到达滴定终点时的现象为____________
(3) 实验测得此加碘盐中KIO3的质量分数=______ ______ (KIO3的相对分子质量为214)。
II.实验室制备KIO3
已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到。
该化学小组通过以下装置制备KIO3
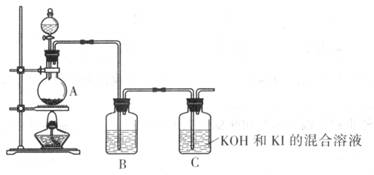
(4) 装置A中反应的离子方程式为____________
(5) 装置B中的试剂为____________
(6) 写出装置C中生成KIO3的离子方程式____________。
(7) 上述实验装置存在一处明显缺陷,请指出: __________________。
查看习题详情和答案>>
