摘要:22.如图所示:以轻杆一端固定质量为m的小球.以另一端O为圆心.使小球作半径为R的圆周运动.以下说法正确的是 A.小球过最高点时.杆所受的弹力可以等于零 B.小球过最高点时的最小速度是 C.小球过最高点时.杆对球的作用力可以欲求所受 的重力方向相反.此时重力一定大于杆对球的作用力 D.小球过最高点时.杆对球的作用力一定与球所受 的重力方向相反 第Ⅱ卷 非选择题
网址:http://m.1010jiajiao.com/timu3_id_378856[举报]
 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.方法甲:取2药匙细小的硫酸铜晶体置于
研钵
研钵
中研碎后放入坩埚,将坩埚放在泥三角
泥三角
上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入干燥器
干燥器
中进行冷却(请选用合适仪器或设备填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角).方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20ml浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干.
交流与讨论:
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是
CuSO4?5H2O
CuO+SO3+5H2O或CuSO4?5H2O
CuO+H2SO4+4H2O
| ||
| ||
CuSO4?5H2O
CuO+SO3+5H2O或CuSO4?5H2O
CuO+H2SO4+4H2O
(用化学方程式表示);
| ||
| ||
(2)方法乙中,浓硫酸的作用是
吸水剂
吸水剂
,为了不浪费药品,对无水乙醇洗涤液进行再生的方法是加CaO后蒸馏
加CaO后蒸馏
,所用的主要玻璃仪器有蒸馏烧瓶、温度计、承接管(牛角管)、锥形瓶酒精灯、冷凝管
酒精灯、冷凝管
等;(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想
铜离子(或硫酸铜)对双氧水分解有催化作用
铜离子(或硫酸铜)对双氧水分解有催化作用
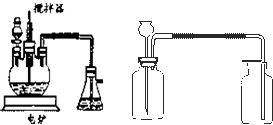
;(4)目前工业上正积极探索用浓HNO3作氧化剂,用Cu与浓H2SO4、浓HNO3反应,采取间歇加热、逐渐加入浓HNO3的方法来制备CuSO4?5H2O 的新工艺.模拟制备装置如图所示.
问题一如图装置中,分液漏斗内装的液体是
浓硝酸
浓硝酸
;反应结束时,获取CuSO4?5H2O的操作过程是先先撤去导管
先撤去导管
,后停止加热
停止加热
;趁热将三颈瓶中的液体倒入烧杯中冷却,析出晶体CuSO4?5H2O,过滤、晾干;问题二工业上用石灰乳吸收尾气,除了防止环境污染外,还能得到了有经济实用价值的副产品----亚硝酸钙.尾气吸收生成亚硝酸钙的化学方程式是:
NO2+NO+Ca(OH)2=Ca(NO2)2+H2O 或4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
NO2+NO+Ca(OH)2=Ca(NO2)2+H2O 或4NO2+2Ca(OH)2=Ca(NO3)2+Ca(NO2)2+2H2O
;问题三将石灰乳稀释,可得到澄清石灰水. 澄清石灰水与CO2相遇能够产生白色沉淀.某同学想用如图所示装置以大理石和稀盐酸反应制取CO2.教师指出制取等量的气体,该装置需要太多的盐酸,造成浪费.该同学对该装置某部位加了一个小试管,解决了这个问题.请你把改进画在图中合适的位置.


 金刚石是常见的原子晶体,若某块金刚石中有n个碳原子,则其中的共价键数目是
金刚石是常见的原子晶体,若某块金刚石中有n个碳原子,则其中的共价键数目是 某研究性学习小组设计了一组实验验证元素性质的递变性规律.
某研究性学习小组设计了一组实验验证元素性质的递变性规律.(1)甲同学想验证同周期元素金属性强弱的规律,最好选用第
三
三
周期的钠、镁、铝
钠、镁、铝
三种元素.最简单的实验是将大小相近的三小块金属分别投入相同浓度的稀盐酸中,观察现象.应该看到的现象是:①
钠剧烈反应,可能着火或爆炸
钠剧烈反应,可能着火或爆炸
,②
镁反应较剧烈,产生大量气泡
镁反应较剧烈,产生大量气泡
,③
铝反应比镁缓慢,有较多的气泡产生
铝反应比镁缓慢,有较多的气泡产生
.(2)乙同学设计实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他设计了如图所示装置以验证氮、碳、硅元素的非金属性强弱.
该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
①写出所选用物质的化学式:
A:
HNO3
HNO3
;B:CaCO3
CaCO3
;C:Na2SiO3
Na2SiO3
.②写出烧杯中发生反应的离子方程式:
CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-
CO2+SiO32-+H2O═H2SiO3↓+CO32-或2CO2+SiO32-+2H2O═H2SiO3↓+2HCO3-
.硝酸是一种重要的化工原料,主要用于化肥、火药、染料、制药、塑料等产品的生产.如图所示为以氨为主要原料制备硝酸的实验装置示意图(夹持装置已经省略).
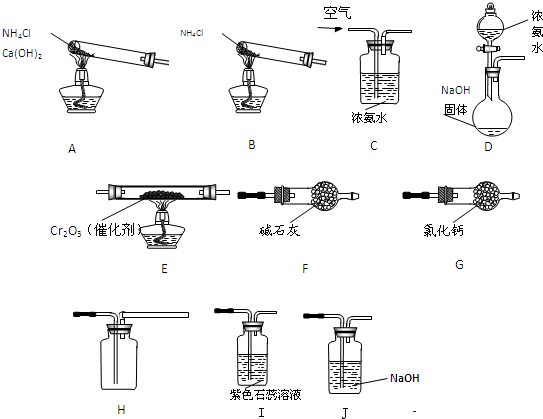
请完成下列问题:
(1)制氨装置最好选择(填相应字母)
(2)写出装置E中发生反应的化学方程式
(3)图中A、B、C、D四种制备氨的方法中不合理的是
(4)装置I、J的作用是
(5)你认为本套装置中
查看习题详情和答案>>

请完成下列问题:
(1)制氨装置最好选择(填相应字母)
C
C
.(2)写出装置E中发生反应的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(3)图中A、B、C、D四种制备氨的方法中不合理的是
B
B
.(4)装置I、J的作用是
检验硝酸的生成
检验硝酸的生成
、吸收多余的尾气,防止污染空气
吸收多余的尾气,防止污染空气
.(5)你认为本套装置中
是
是
(填“是或否”)存在不足?如果你认为存在不足,请提出合理的改进措施将I装置连接一吸有氧气的注射器
将I装置连接一吸有氧气的注射器
. 已知:
已知:①浓磷酸具有吸水性,在加热条件下也难与碳、铜等单质反应.
②生成环己烯的反应:

③相应物质参数表:
| 有机物 | 密度/ g?cm-3 |
熔点/ ℃ |
沸点/ ℃ |
溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
步骤Ⅰ.制备粗品
(1)将12.5mL环己醇加入上图反应装置中的圆底烧瓶A内,再加入2mL质量分数为85%的浓磷酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在锥形瓶D内得到环己烯粗品.其中仪器B的作用是
冷凝回流
冷凝回流
;此反应中不加浓硫酸的原因是防止产物碳化或氧化
防止产物碳化或氧化
.(2)反应装置的水浴温度控制在85℃左右,而不是130℃,是因为
接近环己烯的沸点,防止反应温度过高而碳化,控制恰当的反应速率
接近环己烯的沸点,防止反应温度过高而碳化,控制恰当的反应速率
的缘故.步骤Ⅱ.制备精品
(3)为了提纯环己烯,除去粗品中的环己醇、少量酸和水等杂质,采用如下操作:
①加入饱和食盐水,再振荡、静置、分层、分液,其中食盐可起
盐析
盐析
作用.②分液后再用
C
C
(填序号)试剂洗涤.A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
③再向粗品中加入无水氯化钙后蒸馏.加入无水氯化钙目的是:
吸收水分
吸收水分
.(4)以下区分环己烯精品和粗品的方法,合理的是:
BC
BC
(填序号).A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点.