摘要:20.(1)1 mol高锰酸钾在240-300℃加热释放出19.2g氧气.写出该反应的化学方程式. (已知K2MnO4在640℃分解.K3MnO4在800℃分解) (2)在某温度下.将Cl2通入KOH溶液中.反应后得到KCl.KClO2.KClO3的混合溶液.经测定ClO2-与ClO3-的物质的量之比为1:2.则Cl2与KOH反应时.被还原的Cl和被氧化的Cl的物质的量之比为 .其化学反应方程式为
网址:http://m.1010jiajiao.com/timu3_id_378525[举报]
以提银后含锰废液中获得的碳酸锰、废硫酸及废铬铁催化剂等为原料生产二氧化锰、高铁酸钾及重铬酸钾,原料的综合利用率较高.其主要流程如下: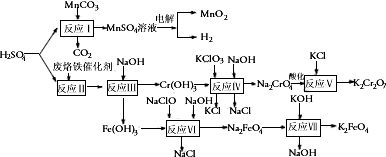
(1)电解硫酸锰酸性溶液时,阳极的电极反应为: .
(2)反应IV中,每生成1molNa2CrO4消耗KClO3 mol.
(3)已知反应V是复分解反应.用离子反应方程式表示Na2CrO4溶液酸化时化学平衡的移动: .
(4)反应VI的离子方程式为: .
查看习题详情和答案>>

(1)电解硫酸锰酸性溶液时,阳极的电极反应为:
(2)反应IV中,每生成1molNa2CrO4消耗KClO3
(3)已知反应V是复分解反应.用离子反应方程式表示Na2CrO4溶液酸化时化学平衡的移动:
(4)反应VI的离子方程式为:
(2010?德阳模拟)[化学选修2:化学与技术]工业上为了使原料和能量得到充分的利用,常常采用循环操作.
Ⅰ、利用热化学循环制氢能缓解能源矛盾.最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢.MnFe2O4的制备:
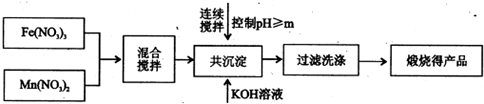
已知Fe3+、Mn2+沉淀的pH如表所示.
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为
(2)控制pH的操作中m的值为
Ⅱ、用MnFe2O4热化学循环制取氢气:MnFe2O4(s)
MnFe2O(4-x)(s)+
8O2(g);△H1=akJ/mol,
MnFe2O(4-x)(s)+xH2O(l)═MnFe2O4(s)+xH2(g);△H2=bkJ/mol,
(3)由上可知,H2燃烧的热化学方程式是
(4)该热化学循环制取氢气的优点是
A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
Ⅲ、工业上可用H2、HCl通过如图的循环流程制取太阳能材料高纯硅.
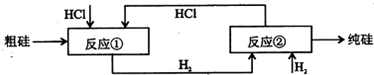
反应①Si(粗)+3HCl(g)
SiHCI3(l)+H2(g)
反应②:SiHCl3(l)+H2(g)
Si(纯)+3HCl(g)
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
查看习题详情和答案>>
Ⅰ、利用热化学循环制氢能缓解能源矛盾.最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢.MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH如表所示.
| 开始沉淀 | 完全沉淀 | |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
2:1
2:1
.(2)控制pH的操作中m的值为
10.4
10.4
.Ⅱ、用MnFe2O4热化学循环制取氢气:MnFe2O4(s)
| ||
| x |
| 2 |
MnFe2O(4-x)(s)+xH2O(l)═MnFe2O4(s)+xH2(g);△H2=bkJ/mol,
(3)由上可知,H2燃烧的热化学方程式是
H2(g)+
O2(g)═H2O(l);△H=-
kJ/mol
| 1 |
| 2 |
| a+b |
| x |
H2(g)+
O2(g)═H2O(l);△H=-
kJ/mol
.| 1 |
| 2 |
| a+b |
| x |
(4)该热化学循环制取氢气的优点是
A、B、C
A、B、C
(填字母编号).A.过程简单、无污染 B.物料可循环使用 C.氧气和氢气在不同步骤生成,安全且易分离
Ⅲ、工业上可用H2、HCl通过如图的循环流程制取太阳能材料高纯硅.

反应①Si(粗)+3HCl(g)
| ||
反应②:SiHCl3(l)+H2(g)
| ||
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%.则在下一轮次的生产中,需补充投入HCl和H2的体积比是
3:1
3:1
.近日,我国科学家研发的比传统锌锰电池能量更高的铝锰电池已取得突破性进展.铝锰电池以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰一石墨为两极,其电池反应为Al+3MnO2+3H2O═3MnO(OH)+Al(OH)3下列有关该电池放电时的说法不正确的是( )