网址:http://m.1010jiajiao.com/timu3_id_378523[举报]
PbO2是很强的氧化剂,在酸性溶液中它可将Mn2+氧化成MnO4―。取一支试管,加入少量PbO2固体和2mL的6mol?L―1H2SO4,然后再加2mL的1mol?L―1MnSO4溶液,试回答:
(1)搅拌后,溶液的颜色变化是______________________________;
(2)写出反应的化学方程式并标出电子转移的方向和数目______________________;
(3)能否用盐酸来代替硫酸___________(填能或不能),用化学方程式解释_______。
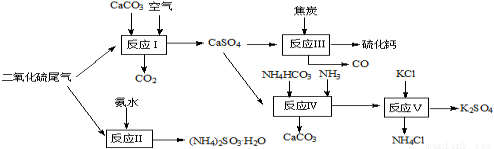
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。 查看习题详情和答案>>
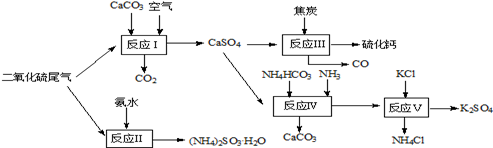
(1)以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合 成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质.合成路线如下:
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
A.滴有酚酞的NaOH溶液 B.酸性KMnO4
C.滴有淀粉的碘水 D.BaCl2溶液.
(2)已知铅蓄电池放电时发生如下反应:
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
查看习题详情和答案>>
① 生产过程中,反应Ⅰ中需鼓入足量空气,试写出该反应的总方程式 。
② 反应Ⅱ中需要向溶液中加入适量的对苯二酚等物质(已知对苯二酚具有很强的还原性),其作用可能是 。
③ 反应Ⅲ中氧化剂与还原剂的物质的量之比为 。
④ 能用于测定尾气中SO2含量的是 。
| A.滴有酚酞的NaOH溶液 | B.酸性KMnO4 |
| C.滴有淀粉的碘水 | D.BaCl2溶液. |
负极:Pb-2e-+SO42-=PbSO4 正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.80L,电解前硫酸溶液浓度为4.50mol.L-1,当制得29.12 L Cl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
| |||||||||||||||