网址:http://m.1010jiajiao.com/timu3_id_378454[举报]
(1)海水淡化由来已久。二次大战时一艘为盟军运送军事物资的商船遇难漂流到一座荒岛上。为了获取淡水,船员们将救生艇上的铜皮空气箱拆下,在空气箱上加盖一块边缘向内卷,曲形成水槽的铜盖,做成一个简易蒸馏器。加热箱内的海水。水蒸气在盖顶冷凝后顺着边缘流进水槽,再滴人淡水桶内。根据上述文字的描述,为下图简易蒸馏器示意图补画铜盖。

 P1
P1 1.013×l05 Pa
1.013×l05 Pa
1)②处海水的温度比①处海水温度高的原因是____________________。
2)盐水能够从一级闪蒸室流入二级闪蒸室的原因是__________________。
3)为降低能耗,多级闪蒸法采取了降压和________两项措施。降压可以降低能耗的理由是___________________。
4)海水淡化亦称海水脱盐。该工艺过程包括海水预处理、脱盐、淡化水的后处理等。下列属于海水预处理的是______ 、______ 、____(填序号)。
①淡水收集②除掉悬浮物③杀灭 海洋生物④除掉海水中的盐分⑤水质 检测⑥降低海水浑浊度为了检验所收集的淡水中是否含有氯离子,通常采用的试剂是_____________。
5)除了从海水中获得淡水之外,人们还可以从中提取其他 物质。《天工开物》中就有海水晒盐的记载(见下图)。试比较多级闪蒸海水淡化与海水晒盐的主要异同点,每项至少写两点。 相同点:_____________。 差异点:_________________。
6)海水淡化是解决淡水资源危机的途径之一。它涉及各个领域。如要建立一个以多级闪蒸法为主要工艺的海水淡化厂,涉及的经济问题有________________;涉及的技术问题有_____________ 。若请你以海水淡化为主题,从一个侧面出发,对其进行探究,你最关注的问题是_____________;根据该问题拟定的课题名称是_____________。

随着全球淡水资源危机日益严重,世界各国都把目光投向了占全球总水量约97%的汪洋大海,希望从苦涩的海水中提取可以饮用的淡水.
(1)海水淡化由来已久.二次大战时,一艘为盟军运送军事物资的商船遇难漂流到一座荒岛上.为了获取淡水,船员们将救生艇上的铜皮空气箱拆下,在空气箱上加盖一块边缘向内卷曲形成水槽的铜盖,做成一个简易蒸馏器.加热箱内的海水,水蒸气在盖顶冷凝后顺着边缘流进水槽,再滴入淡水桶内.根据上述文字的描述,为下图简易蒸馏器示意图补画铜盖.
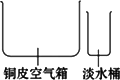
(2)目前海水淡化有了许多新工艺,最广泛应用的为多级闪蒸法,其流程示意图如下图.已知一级闪蒸室和二级闪蒸室内的压强分别是p1和p2,且p2<p1<1.013×105 Pa.
请回答:
a.②处海水的温度比①处海水温度高的原因是________.
b.盐水能够从一级闪蒸室流入二级闪蒸室的原因是________.
(3)为降低能耗,多级闪蒸法采取了降压和________两项措施.降压可以降低能耗的理由是________.
(4)海水淡化亦称海水脱盐.该工艺过程包括海水预处理、脱盐、淡化水的后处理等.下列属于海水预处理的是________、________、________(填序号).
①淡水收集
②除掉悬浮物
③杀灭海洋生物
④除掉海水中的盐分
⑤水质检测
⑥降低海水浑浊度为了检验所收集的淡水中是否含有氯离子,通常采用的试剂是________.
(5)除了从海水中获得淡水之外,人们还可以从中提取其他物质.试比较多级闪蒸海水淡化与海水晒盐的主要异同点,每项至少写两点.
相同点:________.
差异点:________.
(6)海水淡化是解决淡水资源危机的途径之一.它涉及各个领域.如要建立一个以多级闪蒸法为主要工艺的海水淡化厂,涉及的经济问题有________;涉及的技术问题有________.若请你以海水淡化为主题,从一个侧面出发,对其进行探究,你最关注的问题是________;根据该问题拟定的课题名称是________.

(1)最初混合溶液中H2SO4和盐酸的物质的量浓度;
(2)当加入Ba(OH)2体积分别为20mL和40mL时,溶液的pH各为多少?(1g5=0.69,lg6=0.78)
@维生素C是一种水溶性维生素(pH<7),化学式为C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。它易被空气中的O2氧化,在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中含量在500mg×L-1左右。校外活动小组测定了某牌子的橙汁中维生素C的含量,下面是实验报告单,请填写。
(1)测定目的:测定××牌橙汁维生素C的含量
(2)测定原理:C6H8O6+Ⅰ2![]() C6H6O6+2H++2I-
C6H6O6+2H++2I-
(3)实验用品及试剂:
①仪器和用品:自选(略)
②试剂:指示剂________(填名称),7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
(5)数据记录与处理。(设计数据记录和数据处理的表格,不必填数据)若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?答:____________________。
②从分析数据看,此软包装橙汁是不是纯天然橙汁?答:______(填编号)
|
A.是 |
B.可能是 |
C.不是 |
制造商可能采取的做法是______。
|
A.加水稀释天然橙汁 |
B.橙汁已被浓缩 |
C.将维生素C作为添加剂 |
对于上述做法,你的意见是______。
|
A.同意 |
B.不同意 |
C.调查后再作结论 |
查看习题详情和答案>>
有H2SO4和HCl的混合溶液20mL,在这个溶液中加入0.025mol×L-1的Ba(OH)2溶液,生成的BaSO4的量和相对应的溶液的pH如图所示,求解下列问题(保留两位有效数字)。

(1)最初混合溶液中H2SO4和盐酸的物质的量浓度;
(2)当加入Ba(OH)2体积分别为20mL和40mL时,溶液的pH各为多少?(1g5=0.69,lg6=0.78)
@维生素C是一种水溶性维生素(pH<7),化学式为C6H8O6,人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸。它易被空气中的O2氧化,在新鲜的水果、蔬菜、乳制品中都富含维生素C,如新鲜橙汁中含量在500mg×L-1左右。校外活动小组测定了某牌子的橙汁中维生素C的含量,下面是实验报告单,请填写。
(1)测定目的:测定××牌橙汁维生素C的含量
(2)测定原理:C6H8O6+Ⅰ2![]() C6H6O6+2H++2I-
C6H6O6+2H++2I-
(3)实验用品及试剂:
①仪器和用品:自选(略)
②试剂:指示剂________(填名称),7.50´10-3mol×L-1标准碘溶液、蒸馏水等。
(4)实验过程:
①洗涤仪器,检查滴定管是否漏液,润洗后装好标准碘溶液待用。
②打开橙汁包装,目测:颜色——橙黄色,澄清度——好。用________(填仪器名称)向锥形瓶中移入20.00mL待测橙汁,滴入2滴指示剂。
③用左手控制滴定管的________(填部位),右手摇动锥形瓶,眼睛注视________直到滴定终点。滴定至终点的现象是________。
(5)数据记录与处理。(设计数据记录和数据处理的表格,不必填数据)若经数据处理,滴定中消耗标准碘溶液的体积是15.00mL,则此橙汁中维生素C的含量是________mg×L-1。
(6)问题讨论:
①滴定时能否剧烈摇动锥形瓶?为什么?答:____________________。
②从分析数据看,此软包装橙汁是不是纯天然橙汁?答:______(填编号)
|
A.是 |
B.可能是 |
C.不是 |
制造商可能采取的做法是______。
|
A.加水稀释天然橙汁 |
B.橙汁已被浓缩 |
C.将维生素C作为添加剂 |
对于上述做法,你的意见是______。
|
A.同意 |
B.不同意 |
C.调查后再作结论 |
查看习题详情和答案>>
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
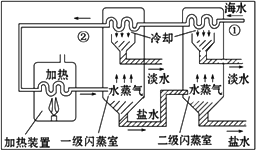
(1)该反应在较低温度下能否自发进行?
(2)从323K到353K,氨气的生成量减少的原因
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
| 4 |
| 7 |
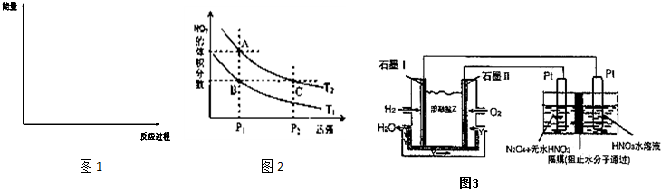
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式