网址:http://m.1010jiajiao.com/timu3_id_378346[举报]
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:
硫酸亚铁片
硫酸亚铁片
本品含硫酸亚铁(FeSO4·7H2O)应为标示量的95.0%~110.0%。
【性状】 本品为糖衣片,除去糖衣后显淡蓝绿色。
【鉴别】 取本品,除去糖衣,研细,称取适量(约相当于硫酸亚铁0.2 g),加稀盐酸1滴与水20 mL,振摇使硫酸亚铁溶解,过滤,滤液进行亚铁盐与硫酸盐的鉴别反应。
【规格】 0.3 g
【贮藏】 密封,在干燥处保存。
(1)药片上的糖衣可以起________的作用,鉴定时溶解加盐酸的目的是____________
____________________________________.
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平外,还需要的仪器有________、________、________、________、 ________。
②滴定时含硫酸亚铁的滤液放在________(填仪器)中,高锰酸钾溶液放在_____(填仪器)中,滴定终点时溶液的颜色为________色。
(3)另一研究小组乙设计了如下测量方案:

①过滤时用到的玻璃仪器有______________________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有________(按操作的顺序填写)。
A.过滤 B.洗涤 C.萃取 D.分液 E.冷却 F.灼烧
查看习题详情和答案>>下列实验操作与预期目的或所得结论一致的是( )
|
(共14分)Ⅰ.化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即用表面皿盖好。(已知2KMnO4+16HCl(浓) 2KCl +2MnCl2 +5Cl2↑+8H2O)?
(1)e处反应的离子方程式为 。
该反应中氧化剂和还原剂的物质的量之比为 。
(2)b处的实验现象: 。?d处的实验现象: 。(3)c处反应的化学方程式为 。
Ⅱ.混合物A由碳酸钠和碳酸氢钠组成。现有两包质量相等的混合物A:
(1)若向其中一包加入100mL 3mol/L的Ba(OH)2溶液(过量),使HCO3-、CO32-全部变为沉淀,过滤后,再向滤液中加入200mL 2mol/L的稀盐酸,溶液恰好呈中性。
①写出下列反应的离子方程式
碳酸氢钠与过量氢氧化钡的反应: ;
②混合物A中NaHCO3的质量为 g。
(2)若向另一包中先加50mL8mol/L的HCl溶液,使HCO3-、CO32-全部变为CO2后,再加50mL2mol/L的Ba(OH)2溶液,混合后的溶液pH=14(混合后溶液体积变化忽略不计、在常温下)。混合物A中Na2CO3的质量为_______________g。
查看习题详情和答案>>
(16分)化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
I、摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水搅拌、过滤。并进行如下实验
(1)、请完成表格中的填空:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液。 | | ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ | |
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
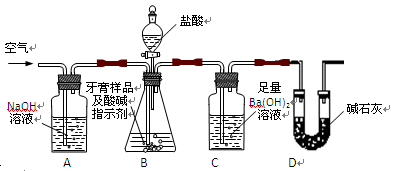
依据实验过程回答下列问题:
(2)、实验过程中先后两次鼓入空气,第二次鼓入空气的目的是:
。
(3)、C中反应生成BaCO3的化学方程式是 。
(4)、下列各项措施中,不能提高测定准确度的是 (填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)、实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g.则样品中碳酸钙的质量分数为 。
(6)、某同学提出将C中的Ba(OH)2换成浓H2SO4,通过测定D装置反应前后的质量差也可以测定CaCO3的含量,假设反应前D装置的质量为m1,实验结束后D装置的质量为m2,则样品中CaCO3的质量为 。实验证明按此测定的结果偏高,原因是 。 查看习题详情和答案>>