摘要:顺10.某溶液中可能存在Br-.CO.SO.Al3+.I-.Mg2+.Na+等七种离子中的几种.现取该溶液进行实验.有如下实验现象: ①向溶液中滴加足量氯水后.溶液变橙色.且有无色无味气体产生 ②向所得橙色溶液中滴加足量BaCl2溶液.无沉淀生成 ③向所得溶液中继续滴加淀粉溶液.溶液不变蓝色 据此可以推断.该溶液中肯定不存在的离子是 A.Mg2+.Na+.CO.I- B. Al3+.Mg2+.SO.I- C.Al3+.Na+.SO.I- D.Al3+.CO.Br-.SO
网址:http://m.1010jiajiao.com/timu3_id_378011[举报]
(08泉州五中模拟)某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
A.②③④ B.①②③ C.①③④ D.①③
查看习题详情和答案>>下列叙述中一定正确的是
[ ]
A.0.1mol/L的CH3COOH溶液中,由水电离的c(H+)为10-13 mol/L
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1︰10
C.仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.1.0 mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
查看习题详情和答案>>
B.pH=2与pH=1的CH3COOH溶液中c(H+)之比为1︰10
C.仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中可能存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.1.0 mol/LNa2CO3溶液:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3)
某溶液中可能含有Ba2+、I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是( )
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I- ⑤可能含有Ba2+.
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I- ⑤可能含有Ba2+.
查看习题详情和答案>>
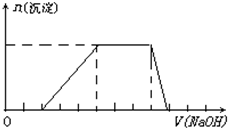 某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液体积的变化如图所示,由此可知,该溶液中一定含有的阳离子是(1)某溶液中可能有下列阴离子:SO42-、CO32-、Cl-.当溶液中存在大量H+时,溶液中不能大量存在的离子是
(2)除去括号中杂质,写出所加试剂的化学式与反应的离子方程式
①SO42-(CO32-),所加试剂
②Cl-(SO42-),所加试剂
(3)氧化还原反应的实质是电子的转移(得失或偏移),氧化反应表现为被氧化的元素化合价
①C+CO2
2CO
②NH4NO3
N2O↑+2H2O
③2KClO3
2KCl+3O2↑
④S+2KNO3+3C═K2S+N2↑+3CO2↑
⑤3Cl2+6NaOH
5NaCl+NaClO3+3H2O
⑥HgS+O2
Hg+SO2.
查看习题详情和答案>>
CO32-
CO32-
;当溶液中存在大量的Ba2+时,溶液中不能大量存在的离子是CO32-、SO42-
CO32-、SO42-
.(2)除去括号中杂质,写出所加试剂的化学式与反应的离子方程式
①SO42-(CO32-),所加试剂
H2SO4
H2SO4
,离子方程式:CO32-+2H+═CO2↑+H2O
CO32-+2H+═CO2↑+H2O
②Cl-(SO42-),所加试剂
BaCl2
BaCl2
,离子方程式:Ba2++SO42-═BaSO4↓
Ba2++SO42-═BaSO4↓
(3)氧化还原反应的实质是电子的转移(得失或偏移),氧化反应表现为被氧化的元素化合价
升高
升高
,其实质是该元素的原子失去(或偏离)电子的过程,发生氧化反应的物质称为还原
还原
剂.根据参与电子转移的元素种类不同的分类方法,下列所提供的反应中电子转移发生在不同价态的同种元素之间的有①②
①②
(填序号,下同);电子转移发生在不同元素之间的有③④⑥
③④⑥
.①C+CO2
| ||
②NH4NO3
| ||
③2KClO3
| ||
| △ |
④S+2KNO3+3C═K2S+N2↑+3CO2↑
⑤3Cl2+6NaOH
| ||
⑥HgS+O2
| ||