摘要:37.某研究小组进行与NH3有关的系列实验. ⑴从下图中挑选所需仪器.画出制取干燥NH3的装置简图(添加必要的塞子.玻璃导管.胶皮管.固定装置和尾气处理装置不用画).并标明所用试剂. ⑵将NH3通入溴水中.有N2生成.反应的化学方程式为 . ⑶为验证“同温同压下.相同体积的任何气体都含有相同数目的分子 .该小组同学设计了如第6页右上图所示的装置.图中B管的容积是A管的2倍.活塞K1.K2.K3.K4.K5均关闭(固定装置和尾气处理装置略,HCl和NH3均不溶于石蜡油.也不与之反应,装置气密性好. ①在A管中充满与大气压强相等的干燥HCl气体.操作是 . 控制活塞K4.K5.调节C.使B管充满与A管同压的干燥NH3. ②缓缓开启K3.A管中的现象是 . 要达到实验目的.当反应完成并恢复到室温时.B管中预期的现象 是 ,若观察不到预期现象. 主要原因是 . 38某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所 得固体M的成分.设计了如右图装置.倾斜A使稀硫酸与固体M充分反应. 待反应停止后.B装置增重.C装置中溶液无变化.反应后进入量气管气体的体积为VmL 由上述实验事实可知: (1)①固体M中一定有的物质是 理由是 ②其中一种物质的质量可以确定为 g. (2)B装置的名称是 . 写出B装置中反应的离子方程式 . (3)C装置的作用是 .如果实验中没有B装置.则C装置中产生的现象是 . (4)稀硫酸和固体M反应后溶液中还残留淡黄色固体.该固体是 ,要分离出该固体.在实验操作中.除烧杯外还需要用到的玻璃仪器是 . (5)通过进一步实验.测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和.产生这种现象的原因可能是 a.M中有未反应的铁和硫 b.测定气体体积时水准管的水面高于量气管的水面 c.A中留有反应生成的气体 d.气体进入D装置前未用浓硫酸干燥
网址:http://m.1010jiajiao.com/timu3_id_377874[举报]
按要求书写热化学方程式(是离子反应的也可用离子方程式表示).
(1)表示强酸和强碱中和热的热化学方程式:
(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环.测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:
(3)由氢气和氧气反应生成1mol水蒸气.放热241.8kJ.写出该反应的热化学方程式:
O2(g)=H2O(l)的△H=
(4)已知A、B两种气体在一定条件下可发生反应:2A+B═C+3D+4E.现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成.在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×106Pa,又测得反应共放出QkJ热量.试根据上述实验数据写出该反应的热化学方程式
查看习题详情和答案>>
(1)表示强酸和强碱中和热的热化学方程式:
H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1
H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1
.(2)火箭推进器常以气态联氨(N2H4)为燃料、液态过氧化氢为助燃剂进行热能提供.反应过程中生成的气体可参与大气循环.测得当反应过程中有1mol水蒸气生成时放出161kJ的热量.试写出反应过程中的热化学方程式:
N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-644kJ?mol-1
N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=-644kJ?mol-1
.(3)由氢气和氧气反应生成1mol水蒸气.放热241.8kJ.写出该反应的热化学方程式:
H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ?mol-1或2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ?mol-1或2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.若1g水蒸气转化成液态水放热2.5kJ,则反应H2(g)+| 1 |
| 2 |
-286.8
-286.8
kJ?mol-1,H2的燃烧热为286.8
286.8
kJ?mol-1(4)已知A、B两种气体在一定条件下可发生反应:2A+B═C+3D+4E.现将相对分子质量为M的A气体mg和足量B气体充入一密闭容器中恰好完全反应后,有少量液滴生成.在相同温度下测得反应前后压强分别为6.06×105Pa和1.01×106Pa,又测得反应共放出QkJ热量.试根据上述实验数据写出该反应的热化学方程式
2A(g)+B(g)═C(g)+3D(l)+4E(g)△H=-
kJ/mol
| 2MQ |
| m |
2A(g)+B(g)═C(g)+3D(l)+4E(g)△H=-
kJ/mol
.| 2MQ |
| m |
(2010?深圳二模)下表为第2、3周期某些元素性质的数据.下列说法正确的是( )
|
查看习题详情和答案>>
(2011?临沂模拟)已知A、B两种气体在一定条件下可发生反应:2A+B=C+3D+4E.现将相对分子质量为M的A气体mg与适量的B充入一个密闭容器内,恰好完全反应,有少量液滴生成,在相同的温度下测得反应前后压强分别为6.06×106和1.01×107Pa,又测得反应共放热Q kJ,下列说法正确的是( )
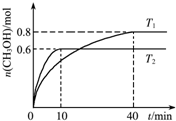 在容积为1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:CO(g)+2H2(g)
在容积为1L的密闭容器中充入1mol CO和2mol H2混合气体,发生以下反应:CO(g)+2H2(g) | 催化剂 |
| A、T1>T2 |
| B、K(T1)>K(T2) |
| C、T1温度下达到平衡后,再充入一定量CO,CO的转化率增大 |
| D、T2温度下,0~10 min间v (H2)=0.06 mol?L-1?min-1 |
根据下表中有关短周期元素性质的数据,判断下列说法不正确的是( )
| |||||||||||||||||||||||||||||||||||||||
查看习题详情和答案>>