摘要:29.KMnO4溶液常用做氧化还原反应滴定的标准液.由于KMnO4的强氧化性.它的溶液很容易被空气中或水中某些少量还原性物质还原.生成难溶性物质MnO(OH)2.因此配制KMnO4标准溶液的操作是: (1)称取稍多于所需量的KMnO4固体溶于水.将溶液加热并保持微沸1 h,(2)用微孔玻璃漏斗过滤除去难溶的MnO(OH)2,(3)过滤得到的KMnO4溶液贮存于棕色试剂瓶放在暗处,(4)利用氧化还原滴定方法.在700C-800C条件下用基准试剂(纯度高.相对分子质量较大.稳定性较好的物质)溶液标定其浓度.请回答下列问题: (1)不用普通滤纸过滤器过滤KMnO4溶液的原因是 , (2)如何保证在700C-800C条件下进行滴定操作: , (3)准确量取一定体积的KMnO4溶液用 , (4)在下列物质中.用于标定KMnO4溶液的基准试剂最好选用 , A.H2C2O4•2H2O B.FeSO4 C.浓盐酸 D.Na2SO3 (5)若准确称取W g.你选的基准试剂溶于水配成500 mL水溶液.取25.00 mL置于锥形瓶中.用高锰酸钾溶液滴定至终点.消耗高锰酸钾溶液V mL.问: ①滴定终点标志是 ,②KMnO4溶液的物质的量浓度为 mol·L-1, (6)若用放置两周的KMnO4标准溶液去滴定水样中Fe2+含量.测得的浓度值将
网址:http://m.1010jiajiao.com/timu3_id_377867[举报]
 (2011?淮安二模)下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( ) (2011?淮安二模)下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
|
查看习题详情和答案>>
 (2009?淮安二模)锰酸锂离子蓄电池是第二代锂离子动力电池.它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+LixC=LiMnO4+C,下列有关说法不正确的是( )
(2009?淮安二模)锰酸锂离子蓄电池是第二代锂离子动力电池.它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+LixC=LiMnO4+C,下列有关说法不正确的是( )
查看习题详情和答案>>
(2009?淮安二模)饮用水安全状况与人类健康有着密切关系.重金属离子对河流、海洋会造成严重污染.沉淀法是处理含重金属离子污水常用的方法.
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.
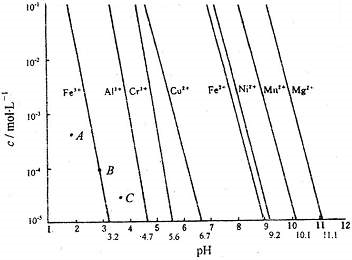
(1)则由上图可得Fe(OH)2的溶度积的值为
(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
①你认为往废水中投入
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
查看习题详情和答案>>
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.

(1)则由上图可得Fe(OH)2的溶度积的值为
1×10-15
1×10-15
.(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
C
C
点.(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
B
B
(填字母序号),沉淀效果最好.A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
1.2×10-3 mol?L-1
1.2×10-3 mol?L-1
.③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
否
否
.(填“是”或“否”)