摘要:被称为“21世纪金属 的钛金属(Ti)有多种同位素.如等.这些同位素原子的中子数不可能为 A.30 B.28 C.26 D.24
网址:http://m.1010jiajiao.com/timu3_id_376483[举报]
(2012?房山区一模)金属钛被称为“21世纪金属”.
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤Ⅱ发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O
①步骤Ⅰ中发生反应的化学方程式:
②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为
③在步骤Ⅲ中需要控制条件以形成TiO2?nH2O胶体,该分散质颗粒直径大小在
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽池,电解TiO2制得钛,其阴极发生的反应:
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g)
TiCl4(g)+O2(g);△H=+151kJ/mol
②TiCl4+2Mg
2MgCl2+Ti
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是:
(3)若已知:C(s)+O2(g)=CO2(g)△H=-394kJ/mol,则由固体TiO2、固体C与Cl2气反应制取气态TiCl4的热化学方程式为
查看习题详情和答案>>
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:

其中,步骤Ⅱ发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O
①步骤Ⅰ中发生反应的化学方程式:
Al2O3+2NaOH=2NaAlO2+H2O
Al2O3+2NaOH=2NaAlO2+H2O
、SiO2+2NaOH=Na2SiO3+H2O
SiO2+2NaOH=Na2SiO3+H2O
.②将步骤Ⅱ所得FeSO4晶体溶于水,在酸性条件下加入H2O2溶液,可制得具有净水作用的铁盐,该反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O;
2Fe2++H2O2+2H+=2Fe3++2H2O;
.③在步骤Ⅲ中需要控制条件以形成TiO2?nH2O胶体,该分散质颗粒直径大小在
1~100nm
1~100nm
范围.(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用碳块作电解槽池,电解TiO2制得钛,其阴极发生的反应:
TiO2+4e-=Ti+2O2-
TiO2+4e-=Ti+2O2-
.方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g)
| 高温 |
②TiCl4+2Mg
| 高温 |
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是:
碳单质与氧气反应减小产物浓度使平衡向右移动,并利用反应放热,导致反应顺利进行,使生成更多TiCl4;
碳单质与氧气反应减小产物浓度使平衡向右移动,并利用反应放热,导致反应顺利进行,使生成更多TiCl4;
.(3)若已知:C(s)+O2(g)=CO2(g)△H=-394kJ/mol,则由固体TiO2、固体C与Cl2气反应制取气态TiCl4的热化学方程式为
TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=-243KJ?mol-1;
TiO2(s)+2Cl2(g)+C(s)=TiCl4(l)+CO2(g)△H=-243KJ?mol-1;
.(10分,每空格2分)原子结构与元素周期表存在着内在联系。请回答下列问题:
(1)具有(n-1)d10ns电子构型的元素位于周期表中 区。
(2)被誉为“21世纪金属”的钛(Ti)元素原子的价电子排布式为: 。
(3)写出地壳中含量最多的金属元素原子的核外电子排布式 。
(4)写出3p轨道上有2个未成对电子的元素的符号: 。
(5)已知Ti3+可形成配位数为6,颜色不同的两种配合物晶体,一种为紫色,另一为绿色。两种晶体的组成都为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:a分别取等质量的两种配合物晶体的样品配成待测溶液;b分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的 。该绿色晶体配合物的化学式为
。该绿色晶体配合物的化学式为
 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为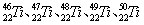 等。这些同位素原子的中子数不可能为
等。这些同位素原子的中子数不可能为