摘要:图象法--运用图象中的函数关系分析计算 一般解题思路: (1)根据题设条件写出各步反应的化学方程式.并通过计算求出各转折点时反应物的用量和生成物的生成量.以确定函数的取值范围. (2)根据取值范围.在图象上依次作起点.转折点.终点.并连接各点形成图象. (3)利用图象的直观性.找出其中的函数关系.快速解题. 例1.准确称取6克铝土矿样品(含Al2O3.Fe2O3.SiO2)放入盛有100ml某浓度的硫酸溶液的烧杯中.充分反应后过滤.向滤液中加入10ml的NaOH溶液.产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图4-5所示.请填空回答: (1)H2SO4溶液的物质的量浓度为 , (2)a=2.3,用于沉淀铁离子.消耗的体积是 ,铝土矿中各组成成分的质量分数:Al2O3为 .Fe2O3为 .SiO2为 . (3)a值的范围应是 .在这个范围内.a值越大. 的质量分数越小 解题思路: (1).由图像可知当加入35mlNaOH溶液时.滤液中过量的硫酸被中和.且Fe3+.Al3+全部沉淀.用整体法分析反应的过程.消耗H离子的物质的量等于OH离子的物质的量.得硫酸的物质的量浓度为:0.035×10×1/2/0.01=1.75 (2).用隔离法考查:从溶解Al(OH)3消耗.推知用于Al3+沉淀所消耗的NaOH溶液30ml.则沉淀Fe3+所消耗的NaOH溶液为:35-30-2.3=2.7(ml) 再根据反应前后各元素的原子的物质的量不变.可分别求出Al2O3.Fe2O3的物质的量为:85%.12%. (3).用隔离法考查:沉淀Fe3+所消耗的NaOH溶液为35-30-a=(5-a)ml不难看出a值肯定应小于5.假设铝矿土样品中不含SiO2.则可求出a的最小值为1.64ml.故a的取值范围为:1.64<a<5 例2.下图是10mgMnC2O4·2H2O放在一个可称量的容器里加热分解时.所得固体产物的质量随温度变化的关系曲线.试利用图中的信息结合所学的知识.回答下列问题: (已知锰在300℃前没有发生价态变化.且其碳酸盐极不稳定) (1)写出B点固体产物的化学式: . (2)由A到B的化学方程式为: . (3)从B到C曲线的意义是: . (4)由图计算产物D的相对分子量.并推断D的合理化学式.
网址:http://m.1010jiajiao.com/timu3_id_374133[举报]
 (1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”.
试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图C,它的化学式是
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 | 3 |
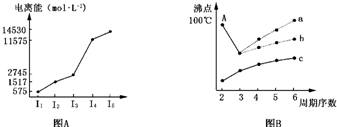
(1)图表法、图象法是常用的科学研究方法.短周期某主族元素M的电离能情况如图A所示.则M元素位于周期表的第
(2)图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
查看习题详情和答案>>
ⅢA
ⅢA
族.(2)图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
ⅣA
ⅣA
族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是b
b
(填“a”或“b”),理由是A点所示的氢化物是水,其沸点高是由于水分子间存在氢键,所以氧族元素中其他氢化物的沸点不会高于水
A点所示的氢化物是水,其沸点高是由于水分子间存在氢键,所以氧族元素中其他氢化物的沸点不会高于水
.
图表法、图象法是常用的科学研究方法.
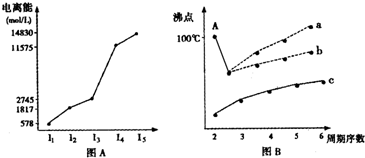
(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
(2)部分有机物的熔沸点见下表:
由这些数据你能得出的结论是(至少写2条):
查看习题详情和答案>>

(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
IIIA
IIIA
族.II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
IVA
IVA
族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是a还是b?并说出理由:b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点
b;A点所示的氢化物是水,由于在水分子间存在氢键,所以其沸点高于氧族元素中的其它氢化物的沸点
.(2)部分有机物的熔沸点见下表:
| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 |  |
 |
 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
同系物相对分子质量越大、分子间作用力越强,故沸点越高
同系物相对分子质量越大、分子间作用力越强,故沸点越高
,当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高)
当有机能形成分子内氢键时,分子间作用力减弱,熔点变低(当分子间能形成氢键时,分子间作用力增强,熔点升高)
.
图表法、图象法是常用的科学研究方法.阅读下列图表回答问题:
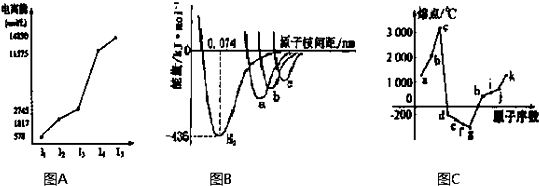
(1)图A是第三周期某主族元素M的电离能变化情况的图象.则M元素位于周期表的 族,根据同周期元素第一电离能的变化规律,推断在M元素所在周期的所有元素中,M元素的第一电离能的大小(最小)范围为 <M< (填元素符号).
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是 (填“a”、“b”、“c”),理由是 .
(3)图C是1~18号元素中部分连号元素单质的熔点变化情况图,其中c点代表的单质是 ,其熔点高的主要原因是 .
查看习题详情和答案>>

(1)图A是第三周期某主族元素M的电离能变化情况的图象.则M元素位于周期表的
(2)图B是表示H2、Cl2、Br2、I2四种分子形成过程中能量随核间距的变化情况的图象,其中表示I2的曲线的是
(3)图C是1~18号元素中部分连号元素单质的熔点变化情况图,其中c点代表的单质是
(2008?揭阳二模)(1)I.图表法、图象法是常用的科学研究方法.
短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可表达第
(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”.试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为
II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是
②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
.则绿色晶体配合物的化学式为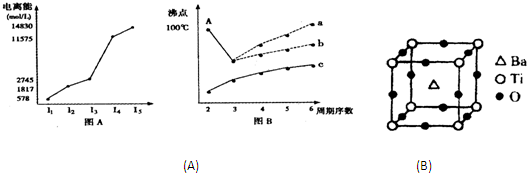
查看习题详情和答案>>
短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
IIIA
IIIA
族.II.图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可表达第
IVA
IVA
族元素氢化物的沸点的变化规律.不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是:b
b
(填“a”或“b”),理由是:A点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水
A点所示的氢化物是水,其沸点高是由于在水分子间存在氢键,所以氧族元素中其它氢化物的沸点不会高于水
.(2).人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”.试回答下列问题:
I.Ti元素的基态原子的价电子层排布式为
3d24S2
3d24S2
;II.在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;
①偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图,它的化学式是
BaTiO3
BaTiO3
;晶体内与每个“Ti”紧邻的氧原子数为6
6
个.②已知Ti3+可形成配位数为6的配合物.现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;
b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 | 3 |
[TiCl(H2O)5]Cl2?H2O
[TiCl(H2O)5]Cl2?H2O
.