网址:http://m.1010jiajiao.com/timu3_id_374005[举报]
(18分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。请设计实验,证明还原铁粉与水蒸气能够发生反应。
(1) 铁粉与水蒸气反应的化学方程式是:
(2)证明还原铁粉与水蒸气发生了反应的方法是
(3)某同学用如图所示装置进行实验,请帮助该同学完成设计,用下列简图画出未完成的实验装置示意图(铁架台可省略,导气管的形状可根据需要选择)
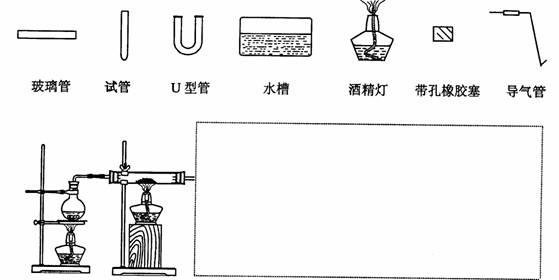
(4)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法:
(5)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含十3价的Fe元素。原因是(结合化学方程式说明)
(6)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→叶红褐色的化学方程式是:
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,可采取的措施有多种,请写出其中的两种。
第一种:
第二种:
查看习题详情和答案>>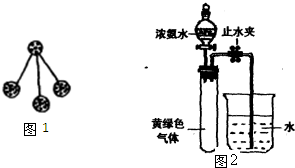 甲、乙、丙、丁是由短周期元素组成的四种物质,它们之间存在如下转化关系:甲+乙→丙+丁
甲、乙、丙、丁是由短周期元素组成的四种物质,它们之间存在如下转化关系:甲+乙→丙+丁(1)若转化关系中所涉及的反应为非氧化还原反应,且乙为水.若甲是由N和Cl元素组成的化合物,其分子结构模型如图1所示,丙具有漂白性.则甲中Cl元素的化合价是
(2)若转化关系中所涉及的反应为氧化还原反应,且乙为水.
①若丙和丁都可在一定条件下还原CuO,则:甲+乙一丙+丁的化学方程式是
②若甲是由N和O元素组成的气态物质,呈红棕色.则甲+乙→丙+丁的化学方程式是
(3)Hofmann依据上述转化关系:甲+乙→丙+丁,测定氨分子的组成,现用如图2所示的装置进行实验,打开分液祸斗的话塞,滴下浓氨水,至不再反应为止;关闭分液漏斗的活塞,待恢复到室温,打开止水夹,试管内液面上升至
| 2 | 3 |
| ||
| △ |

(1)工业上,由石油获得石蜡油的方法是
(2)丁烷是由石蜡油获得A的过程中的中间产物之一,它的一种同分异构体中含有三个甲基,则这种同分异构体的结构简式是:


(3)A→B的化学方程式是
| 催化剂 |
| 催化剂 |
(4)B→C的化学方程式为
| Cu或Ag |
| △ |
| Cu或Ag |
| △ |
(5)实验室用如图所示装置制备少量乙酸乙酯.

①写出制备乙酸乙酯的化学方程式
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |
②试管I中盛有由
③试管II中的盛有
④研究表明质子酸离子也可用作酯化反应的催化剂.通过对比实验可以研究不同催化剂的催化效率,实验中除了需控制反应物乙酸、乙醇的用量相同外,还需控制的实验条件是
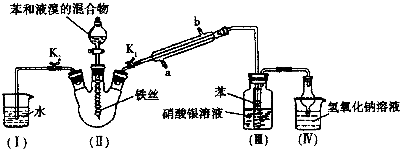
(1)冷凝管所起的作用为冷凝回流和气,冷凝水从
(2)实验开始时,关闭K2、开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始.Ⅲ中小试管内苯的作用是
(3)能说明苯与液溴发生了取代反应的现象是
(4)反应结束后,要让装置I中的水倒吸入装置Ⅱ中.这样操作的目的是
(5)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯.
①用蒸馏水洗涤,振荡,分液;
②用5%的NaOH溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;
④加入无水CaCl2粉末干燥;
⑤
 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:(1)浓硫酸的作用是:①
(2)饱和碳酸钠溶液的主要作用是
(3)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的
(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
(5)进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是
(6)实验室可用乙醇来制取乙烯,将生成的乙烯通入溴的四氯化碳溶液,反应后生成物的结构简式是


(7)生成乙酸乙酯的反应是可逆反应,反应物不能完全转化为生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态.下列描述能说明该反应已达到化学平衡状态的是(填序号)
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.