摘要:11.水是宝贵的自然资源.下列关于水的说法正确的是 A.在干燥时水的晶体是干冰 B.水分子是极性分子.分子之间存在氢键 C.在0.1mol·L-1 NaOH溶液中.水电离的c(OH-)= 0.1mol·L-1 D.将水加热.Kw增大.pH不变
网址:http://m.1010jiajiao.com/timu3_id_372288[举报]
水是宝贵的自然资源.下列关于水的说法正确的是( )
| A、在干燥时水的晶体是干冰 | B、水分子是极性分子,分子之间存在氢键 | C、在0.1mol?L-1NaOH溶液中,水电离的c(OH-)=0.1mol?L-1 | D、将水加热,Kw增大,pH不变 |
海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理.
(1)利用氯碱工业产品处理含SO2的烟气的流程如图:
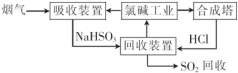
①“吸收装置”中发生反应的离子方程式是 .
②上述流程中循环利用的物质是 .
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题.其工艺流程如图所示:
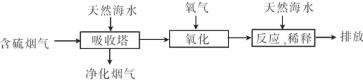
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是 ;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是 .
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁.
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是 .
②要利用MgCl2?6H2O制得无水氯化镁.应采取的措施是 .
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为同体镁.下列物质中可以用作镁蒸气的冷却剂的是 (填字母).
A.Ar B.CO2 C 空气 D.O2 F.水蒸气. 查看习题详情和答案>>
(1)利用氯碱工业产品处理含SO2的烟气的流程如图:

①“吸收装置”中发生反应的离子方程式是
②上述流程中循环利用的物质是
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题.其工艺流程如图所示:

天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁.
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是
②要利用MgCl2?6H2O制得无水氯化镁.应采取的措施是
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为同体镁.下列物质中可以用作镁蒸气的冷却剂的是
A.Ar B.CO2 C 空气 D.O2 F.水蒸气. 查看习题详情和答案>>
海水是宝贵的自然资源,从海水中可以提取多种化工原料,某工厂对海水综合利用的示意图如下所示:
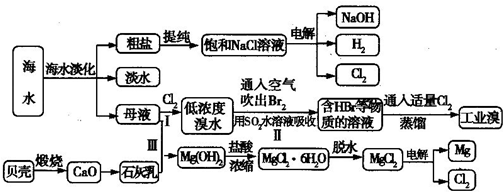
(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
(2)工业上电解饱和食盐水的离子方程式为
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A.H2 B.CO2 C.空气 D.O E.水蒸气.
查看习题详情和答案>>

(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是
②④③①或③②④①或②③④①
②④③①或③②④①或②③④①
(填编号).(2)工业上电解饱和食盐水的离子方程式为
2Cl-+2H2O
Cl2↑+H2↑+2OH-
| ||
2Cl-+2H2O
Cl2↑+H2↑+2OH-
.
| ||
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是
富集溴元素;
富集溴元素;
.步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:
Br2+SO2+2H2O=4H++SO42-+2Br-
Br2+SO2+2H2O=4H++SO42-+2Br-
.(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入
氯化镁
氯化镁
溶液,充分搅拌后经过滤
过滤
(填操作方法)可得纯净的Mg(OH)2.(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2?6H2O受热产生的水汽,故能得到无水MgCl2
.(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是
A
A
(填序号).A.H2 B.CO2 C.空气 D.O E.水蒸气.
海水是宝贵的自然资源.利用海水水可以得到一系列产品.也可以进行废气处理。
(1)利用氯碱工业产品处理含SO2的烟气的流程如下:
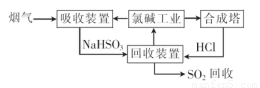
①“吸收装置”中发生反应的离子方程式是??????????????????? .
②上述流程中循环利用的物质是??????????????? 。
(2)利用海水脱硫可以有效地解决煤燃烧排放的SO2造成的一系列环境问题。其工艺流程如图所示:
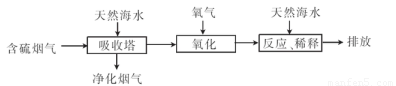
天然海水吸收含硫的烟气后.需要用氧气进行氧化处理.其反应原理的化学方程式是????????? ;氧化后的海水需要加入氢氧化钠.与之混合后才能排放.该操作的主要目的是???????? 。
(3)从海水中捉纯粗盐后的母液中含有K+、Na+、Mg2+等阳离子.对母液进行一系列的加工可制得金属镁。
①从离子反席的角度思考.在母液中加入石灰乳所起的作用是????????????? 。
②要利用MgCl2·6H2O制得尢水氯化镁.应采取的措施是????????????? 。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁.下列物质中可以用作镁蒸气的冷却剂的是?????? (填字母)。
A.Ar??? B.CO2???? C 空气???? D.O2??? E.水蒸气
查看习题详情和答案>>
海水是宝贵的自然资源,从海水中可以提取多种化工原料,某工厂对海水综合利用的示意图如下所示:
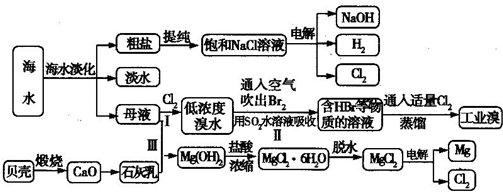
(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是______(填编号).
(2)工业上电解饱和食盐水的离子方程式为______.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______.
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:______.
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入______溶液,充分搅拌后经______(填操作方法)可得纯净的Mg(OH)2.
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:______.
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是______(填序号).
A.H2 B.CO2 C.空气 D.O E.水蒸气.
查看习题详情和答案>>

(1)在粗盐中含有SO42-、Ca2+、Mg2+等杂质,电解精制时所用的试剂有①盐酸;②氯化钡溶液;③氢氧化钠溶液;④碳酸钠溶液,则加入试剂的先后顺序是______(填编号).
(2)工业上电解饱和食盐水的离子方程式为______.
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的是______.
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,写出有关反应的离子方程式:______.
(4)从步骤Ⅲ得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是向沉淀中加入______溶液,充分搅拌后经______(填操作方法)可得纯净的Mg(OH)2.
(5)在制取无水氯化镁时需要在干燥的HCl气流中加热MgCl2?6H20的原因:______.
(6)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气冷却剂的是______(填序号).
A.H2 B.CO2 C.空气 D.O E.水蒸气.