摘要:14.50g浓度为c mol/L.密度为ρg/cm3 的氨水中加入一定量的水稀释成0.5c mol/L.则加入水的体积为 A.小于50mL B.等于50mL C.大于50mL D.等于50/ρmL
网址:http://m.1010jiajiao.com/timu3_id_371947[举报]
50g浓度为c mol·L-1,密度为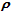 g·cm-3的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积为
g·cm-3的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积为
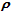 g·cm-3的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积为
g·cm-3的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积为 A.小于50ml
B.等于50ml
C.大于50ml
D.等于50/pml
查看习题详情和答案>>
B.等于50ml
C.大于50ml
D.等于50/pml
在空气中放置一段时间的KOH固体,经分析知其中含水a%,含K2CO3b%,其余为KOH,取此样品mg溶于50g浓度为19.6%的稀硫酸中,所得溶液尚需加入ng KOH固体才能完全中和,然后将溶液蒸干可得固体物质的质量是
[ ]
A.3.1(m+n)g B.14.2g
C.17.4g D.不能确定
查看习题详情和答案>>|
50g浓度为cmol/L、密度为ρg/cm3的氨水中加入一定量的水稀释成0.5cmol/L,则加入水的体积为 | |
| [ ] | |
A. |
小于50mL |
B. |
等于50mL |
C. |
大于50mL |
D. |
等于50/ρmL |
I.(1)如果SO2的漂白性是因为SO2与H2O反应的产物的漂白作用,那么SO2使品红溶液褪色的粒子可能是 .有一Na2SO3固体因部分被氧化而变质.为测定样品纯度,某同学设计了如下实验方案:称取m g样品溶于水,配成250mL溶液,用滴定管取V1 mL于锥形瓶中,用浓度为c mol?L-1 的标准酸性高锰酸钾溶液滴定至终点.反应关系为SO32-+MnO4_→SO42-+Mn2++H2O (未配平)
(2)配制样品溶液时,不一定需要的实验仪器是 (选填答案编号)
A、容量瓶B、玻璃棒 C、滴定管
(3)滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用 .
(4)滴定终点的现象是 .
(5)滴定至终点消耗高锰酸钾溶液的体积为V2 mL,则原样品中Na2SO4的质量分数为
Ⅱ.FeCO3是白色沉淀,已知Ksp(FeCO3)=2×10-11,将FeCl2稀溶液与Na2CO3溶液等体积混合,若原FeCl2溶液的浓度为2×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为 mol/L.
查看习题详情和答案>>
(2)配制样品溶液时,不一定需要的实验仪器是
A、容量瓶B、玻璃棒 C、滴定管
(3)滴定管在注入酸性高锰酸钾溶液之前,先用蒸馏水洗净,再用
(4)滴定终点的现象是
(5)滴定至终点消耗高锰酸钾溶液的体积为V2 mL,则原样品中Na2SO4的质量分数为
Ⅱ.FeCO3是白色沉淀,已知Ksp(FeCO3)=2×10-11,将FeCl2稀溶液与Na2CO3溶液等体积混合,若原FeCl2溶液的浓度为2×10-5 mol/L,则生成沉淀所需Na2CO3溶液最小浓度为