网址:http://m.1010jiajiao.com/timu3_id_371887[举报]
 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为
(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含
(3)Y 的基态原子的核外电子排布式为
(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有 18 个电子.乙和丙的化学式分别是
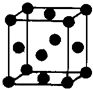
(5)Z单质晶体的晶胞如右图所示,其配位数为:
写出下列反应的离子方程式:(每题3分5小题共15分)
(1)石灰石溶于稀盐酸
(2)稀硫酸与氢氧化钡溶液的反应
(3)碳酸钠溶液与硝酸反应
(4)氢氧化铜与稀硫酸反应
(5)向澄清石灰水中通入少量的二氧化碳
(15分)A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
⑴常温下,X、Y的水溶液的pH均为5.则两种水溶液中由水电离出的H+浓度之比是 .
⑵A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 .
⑶A、B、D、E四种元素组成的某无机化合物浓度为0.1 mol/L时,pH最接近 .
A.5.6 B.7.0 C.8.4 D.13.0
⑷在一个装有可移动活塞的容器中进行如下反应:C2(g)+3A2(g) 2CA3(g)
2CA3(g)
ΔH=-92.4 kJ·mol-1.反应达到平衡后,测得容器中含有C2 0.5mol,A2 0.2mol,CA3 0.2 mol,总容积为1.0 L.
①如果达成此平衡前各物质起始的量有以下几种可能,其中不合理的是________:
A.C2 0.6mol,A2 0.5mol,CA3 0mol
B.C2 0mol,A2 0mol,CA3 1.2mol
C.C2 0.6mol/L,A2 0.5mol/L,CA3 0.2mol/L
②求算此平衡体系的平衡常数K=________;
③如果保持温度和压强不变,向上述平衡体系中加入0.18molC2,平衡将________(填“正向”、“逆向”或“不”)移动.理由是
.
④已知0.4mol 液态C2 A4与足量的液态双氧水反应,生成C2和水蒸气,放出256.65 kJ
的热量.写出该反应的热化学方程式 .
查看习题详情和答案>>
【化学——选修:物质结构与性质】( 15分)
原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| | A | B | C | D | E | F |
| 主要化合价 | -1 | -3 +5 | -2 +6 | -1 +7 | +2 | +1 +2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是 (填元素符号);
(2)B的氢化物中心原子采取 杂化,空间构型是 形,是 分子
(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的化学式为 ,F单质晶体晶胞是下图的
(填①、②、③或④);
(4)A 、E两种元素形成晶体晶胞是下图中的 (填①、②、③或④),A离子的配位数是 ;

(5)右图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,
请选出C的氢化物所在的折线 (填n、m、x或y)。
 查看习题详情和答案>>
查看习题详情和答案>>
(15分)中学化学常见部分元素原子结构及性质如下表所示:
| 序号 | 元素 | 结构及性质 |
| ① | A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 |
| ② | B | B原子K、L、M层电子数之比是1:4:1 |
| ③ | C | C是活泼非金属元素,其单质常温下呈气态但化学性质稳定 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料[来源:Z*xx*k.Com] |
| ⑤ | E | 通常情况下,E没有正化合价,A、C、F都能与E形成二种或二种以上化合物 |
| ⑥ | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
②检验某溶液中含A的低价离子而不含其高价离子的方法是
。
(2)B与C形成的化合物的电子式为 。
(3)①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的实验方法是_____________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则N的结构式为________。
(4)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)______________________ ___________________________。
(5)(在25°C、101 kPa下,已知D的气态氢化物在氧气中完全燃烧后恢复至原状态,平均每转移1 mol电子放热190.0 kJ,该反应的热化学方程式是
________________________________________________________________。 查看习题详情和答案>>